
下列说法中正确的是( )
A.在Na2CO3溶液中滴入酚酞试液,呈红色
B.(NH4)2SO4溶液中c(NH )∶c(SO
)∶c(SO )=2∶1
)=2∶1
C.FeCl3溶于水使溶液呈酸性,从而抑制水的电离
D.将Al2(SO4)3溶液蒸干得到Al(OH)3固体
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
在25℃时,将pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.[Na+]=[CH3COO-]+[CH3COOH]
B.[H+]=[CH3COO-]+[OH-]
C.[Na+]>[CH3COO-]>[OH-]>[H+]
D.[CH3COO-]>[Na+]>[H+]>[OH-]
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
恒温下,反应aX(g)  bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
A.a>b+c B.a<b+c
C.a=b+c D.a=b=c
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。
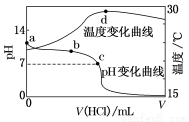
下列有关说法正确的是( )
A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点:c(NH )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH )
)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
A.pH=9 B.c(OH-)≈10-5 mol·L-1
C.pH≈7 D.c(OH-)<10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:填空题
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。已知K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2变化曲线的是__________,用O2表示从0 s~2 s 内该反应的平均速率v=________。
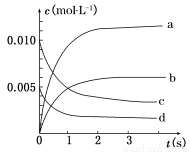
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题2 反应速率与化学平衡练习卷(解析版) 题型:选择题
在恒容密闭容器中通入A、B两种气体,在一定条件下发生反应:
2A(g)+B(g)  2C(g) ΔH>0。
2C(g) ΔH>0。
达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
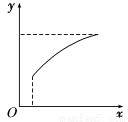
选项 | x | y |
A | 再通入A | B的转化率 |
B | 加入催化剂 | A的体积分数 |
C | 压强 | 混合气体的总物质的量 |
D | 温度 | 混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:填空题
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_______________________
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。

正极反应_______________________________
负极反应_______________________________
查看答案和解析>>
科目:高中化学 来源:2014年高中化学人教版选修四第二章 化学反应速率与化学平衡练习卷(解析版) 题型:填空题
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示:
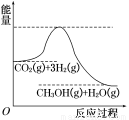
(1)上述反应平衡常数K的表达式为 ,温度降低,平衡常数K (填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2)= 。
t/min | 0 | 2 | 5 | 10 | 15 |
n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是 (填写序号字母)
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1 mol CO2和3 mol H2
d.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com