
| A. |  | B. |  | C. |  | D. | 氢碘酸 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
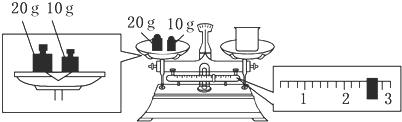
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a-b}{a}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{2a-b}{a}$ | D. | $\frac{2a-b}{b}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙
氢化钙(CaH2)是二种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气.•某研究性学习小组模拟生产企业制取氢化钙| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| 取少量固体样品,•… |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.8NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 1mol甲基(-14C1H3)所含的中子数和电子数分别为8NA、9NA | |
| D. | 含4molHCl的浓盐酸与足量的二氧化锰在加热条件下反应,一定能产生NA个Cl2气体分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com