
【题目】现有如下微粒:
①I2 ②Br- ③Na+ ④Fe2+ ⑤H+ ⑥Fe3+
⑦Mg ⑧Cl2 ⑨HCl ⑩H2O S SO2
其中在反应中只能作还原剂的有 , 只能作氧化剂的有 , 既可作氧化剂又可作还原剂的有。
科目:高中化学 来源: 题型:
【题目】以某废催化剂(含Al2O3 36%、CoS 20%、MoS2 20%、MgO 8%等)为原料生产Co2O3的工艺路线如下:
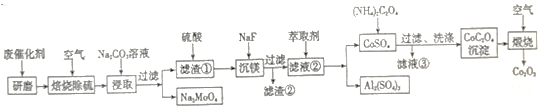
已知: 氧化铝有两种晶型α-Al2O3 和γ- Al2O3,α- Al2O3致密难溶于酸和碱。
(1)废催化剂焙烧前先将其研磨,其目的是_________________________。
(2)已知“焙烧除硫”后的产物有CoO、MoO3。写出Na2CO3溶液“浸取”过程的离子反应方程式:______________________。
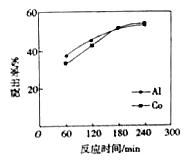
(3) 硫酸浸泡滤渣①的实验条件为硫酸浓度12 mol/L、液固比为3、反应温度60℃。该条件下,铝、钴浸出率与时间关系如图。当浸泡时间小于180 min时,铝、钴浸出率随着时间的推移均增加较快;180 min 后铝和钴的浸出率都提高不多,且钴浸出率高于铝浸出率。试解释180min后钴浸出率高于铝浸出率的原因: ____________________。
(4)萃取剂对Al3+、Co2+萃取率与pH 的关系如图。
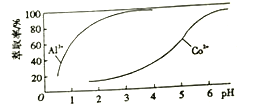
萃取分离钴、铝的实验操作为: 向萃取分液后的有机相中加硫酸调pH=3~4,分液可得CoSO4溶液,___________,可得Al2(SO4)3溶液。
(5)“滤液③”主要物质的化学成分是_______ (写化学式),用途之一为___________________。
(6)“煅烧”过程 相关反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A.用两块铜片作电极电解盐酸:Cu + 2H+ ![]() H2↑ + Cu2+
H2↑ + Cu2+
B.NaOH溶液与足量的Ca(HCO3)2溶液反应:2HCO3- + 2OH- + Ca2+==CaCO3↓+ 2H2O
C.等物质的量的FeBr2和Cl2在溶液中的反应:2Fe2+ + 2Br - + 2Cl2==2Fe3+ + Br2 + 4Cl -
D.氨水吸收少量的二氧化硫:2NH3·H2O + SO2==2NH4+ +SO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
![]() +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
![]() +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式
______![]() +______Fe2++______H+ =______Mn2++______Fe3++______H2O
+______Fe2++______H+ =______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)混合物中Cu2S的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的反应,属于同一反应类型的是( )
A.由溴丙烷水解制丙醇;由丙烯与水反应制丙醇
B.由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸
C.由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯水解制苯甲酸和乙醇
D.由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.3g钠放入97.7g水中,下列说法正确的是
A. 电子转移的数目为2NA
B. 所得溶液的质量分数是等于4%
C. 产生气体的体积为1.12L
D. 产生的气体含有0.1mol的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含汞废水主要来源于氯碱工业和塑料工业,未经处理不得排放。某含汞酸性废水(主要含Hg2+、H+、Na+、Cl-等)的处理工艺流程如下图所示:

请回答:
(1)含汞废水未经处理直接排放的危害是_________(填字母)
a.造成水体污染 b. 引起人体中毒
(2)调节pH时加入的溶液A可能是__________(填字母)
a. 盐酸 b. NaOH溶液
(3)图示所用到的废水处理方法为_____________,其中Na2S与Hg2+发生反应的离子方程式为________________________________________。
(4)该废水经处理后,测得有关数据如下(其他离子忽略不计):
离子 | Na+ | Fe2+ | Cl- | SO42- |
浓度(mol/L) | 3.0×10-4 | c | 2.0×10-4 | 2.5×10-4 |
则c(Fe2+) = ______________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外兴趣小组需要用 18 mol/L 的浓硫酸配制80mL 3.0 mol/L 稀硫酸的实验步骤如下: ① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 稀释 ④ 检漏、 转移、洗涤⑤ 定容、摇匀 回答下列问题:
(1)所需浓硫酸的体积是__________ mL, 量取浓硫酸所用的量筒的规格是___________ (用下列编号填空) 。
A.10 mL B.25 mL C.50 mL D.100 mL
(2)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线__________, 改用___________向容量瓶中滴加蒸馏水至_________________________为止。塞紧瓶塞,倒转摇匀并转移至试剂瓶中。
(3)下列情况对所配制的稀硫酸浓度有何影响? (填 “ 偏大 ”“ 偏小 ” 或 “ 无影响”)
①容量瓶用蒸馏水洗涤后残留有少量的水_________________
②在转入容量瓶前烧杯中溶液未冷却至室温_________
③取完浓硫酸后洗涤量筒,并把洗涤液倒入烧杯___________。
④定容结束时俯视刻度线_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com