
| A. | 锌粒与稀硫酸反应时,加入少量醋酸钠,则反应速率降低 | |
| B. | 醋酸比硫酸对衣服的腐蚀性差 | |
| C. | 0.1 mol•L-1醋酸钠溶液的pH约为9 | |
| D. | 用NaOH溶液中和等体积,相同pH的盐酸和醋酸,盐酸消耗NaOH溶液的体积小 |
分析 A、锌与稀硫酸反应时,加入醋酸钠溶液,硫酸与醋酸钠反应生成弱电解质醋酸,导致溶液中氢离子浓度减小反应减慢;
B、酸性强弱与腐蚀性无关;
C、测得醋酸钠溶液的pH>7,说明醋酸钠为强碱弱酸盐;
D、中和pH与体积均相同的盐酸和醋酸溶液,醋酸消耗的NaOH的物质的量多,醋酸的浓度大.
解答 解:A、锌与稀硫酸反应时,加入醋酸钠溶液,硫酸与醋酸钠反应生成弱电解质醋酸,导致溶液中氢离子浓度减小反应减慢,可以证明醋酸是弱酸,故A不选;
B、酸性强弱与腐蚀性强弱无关,不能证明酸性强弱,故B选;
C、测得醋酸钠溶液的pH>7,说明醋酸钠为强碱弱酸盐,水解呈碱性,可证明醋酸为弱酸,故C不选;
D、中和pH与体积均相同的盐酸和醋酸溶液,醋酸消耗的NaOH的物质的量多,醋酸的浓度大,可以证明醋酸是弱酸,故D不选;
故选B.
点评 本题考查弱电解质的电离,侧重于弱酸的实验角度的探究,注意把握实验原理和角度,学习中注意相关基础知识的积累,难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
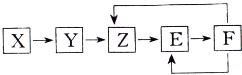 下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )
下列常见物质X、Y、Z、E、F均含有同一元素M,它们在一定条件下有如图所示的转化关系,已知Z为NO,以下有关这五种物质的推断中合理的是( )| A. | X一定含有氮元素,可能是单质也可能是化合物 | |
| B. | X→Y一定是氧化还原反应 | |
| C. | 常温下F与碳单质反应可能生成Z | |
| D. | 若X为单质,Y→Z可能属于化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| B. | 室温下,31g白磷分子中含有共价键数目为4NA | |
| C. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| D. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com