
下列各组物质,不用任何试剂即可鉴别的是( )
A.NaCl、NaBr、KI三种无色溶液
B.HCl、NaCl、NaNO3、Na2CO3四种溶液
C.NaBr、HCl、KCl三种溶液
D.淀粉、淀粉碘化钾、碘化钾、溴水四种溶液
科目:高中化学 来源: 题型:
下列图示与对应的叙述相符的是( )

A. 图Ⅰ表示盐酸滴加到0.1 mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂
B. 图Ⅱ表示一定条件下进行的反应2SO2+O22SO3 各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积
C. 图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2 溶液时铝离子恰好沉淀完全
D. 图Ⅳ表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是( )
A.浓H2SO4、浓HNO3均能使Fe钝化
B.Na2SO3溶液与BaCl2溶液相混合,有白色沉淀生成,加稀盐酸后沉淀消失
C.将SO2通入CaCl2溶液中,有白色沉淀生成
D.工业上制备硝酸的主要设备是热交换器、转化器和吸收塔
查看答案和解析>>
科目:高中化学 来源: 题型:
现欲设计一个实验,验证红热的炭与浓硫酸发生反应所生成的各种产物。有一个同学按气体的流动方向设计了一个实验流程,其装置图如下。
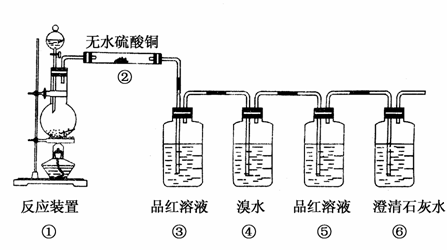
(1)①中反应的化学方程式为__________________________________。
(2)②处的现象是:_______________________________________ ___________________________。
(3)品红溶液使用了两次,第一次使用时的作用是________________________。第二次使用时的作用是__________________________。
(4)④的作用是:________________________;反应的化学方程式为:________________________________________。
(5)根据__________________________________现象可证明产物中一定有CO2气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应实验,设计正确且能达到实验目的的是( )
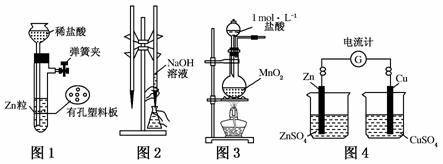
A.用图1所示装置制取少量H2
B.用图2所示装置进行用已知浓度的氢氧化钠溶液测定盐酸的浓度的实验
C.用图3所示装置制取少量Cl2
D.用图4所示装置确定导线中有电流通过及电流方向
查看答案和解析>>
科目:高中化学 来源: 题型:
将二氧化硫通入溴水中发生如下的反应:SO2+Br2+2H2O═2HBr+H2SO4,反应中转移的电子数和还原剂是( )
|
| A. | 2e﹣,H2SO4 | B. | 4e﹣,SO2 | C. | 2e﹣,Br2 | D. | 2e﹣,SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
|
| A. | 9.0 L | B. | 13.5 L | C. | 15.7 L | D. | 16.8 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
明矾石的主要成分是K2SO4·Al2(SO4)3·2Al 2O3·6H2O,此外还含有少量Fe2O3杂质。利用明矾石来制备Al2O3、K2FeO4和H2SO4的工艺流程如下: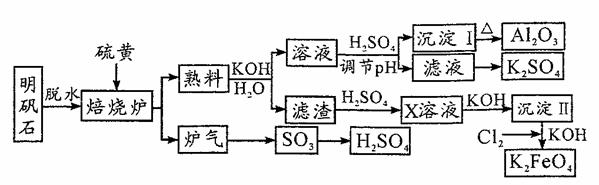
请回答下列问题:
(1)“焙烧”过程中反应的化学方程式为2Al2(SO4)3+3S =2Al2O3 +9SO2,该反应中氧化剂与还原剂的物质的量之比是 _ 。若生成102g Al2O3,转移的电子数目为 。
(2)写出化学式:沉淀Ⅰ是 ,沉淀Ⅱ是 ___________ 。
(3)熟料溶解时反应的离子方程式为______________________________________________。
(4)溶液经加硫酸调节pH后,过滤、洗涤,可得沉淀Ⅰ,证明沉淀Ⅰ已洗涤干净的实验操作和现象是 。
(5)写出Cl2将沉淀Ⅱ氧化为K2FeO4的化学方程式:
______________________________________ 。
(6)“焙烧”过程中生成的SO2可用于制H2SO4。已知25℃,101kPa时:
2SO2(g) + O2(g)  2SO3 (g) △H1=-197.0kJ•mol-1
2SO3 (g) △H1=-197.0kJ•mol-1
H2O(g)=H2O(l) △H 2=-44.0 kJ·mol-1
2SO2(g) + O2(g) + 2H2O(g) =2H2SO4 (l) △H3=-545kJ•mol-1
则SO3 (g)和H2O(l)反应的热化学方程式为 _________ 。
(7)本工艺流程中可循环物质为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com