
【题目】镍在金属羰基化合物(金属元素和CO中性分子形成的一类配合物)、金属储氢材料(能可逆地多次吸收、储存和释放H2的合金)等领域用途广泛。
(1)基态Ni原子核外电子排布式为__________________________。
(2)Ni(CO)4中镍元素的化合价为__________,写出与CO互为等电子体的带一个单位正电荷的阳离子为:_______。Ni(CO)4的一氯代物有2种,其空间构型为_______________ o
(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示,则该晶体的化学式为_____________

(4)下列反应常用来检验Ni2+,请写出另一产物的化学式:_______________。
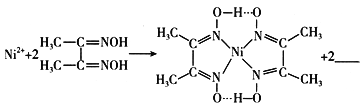
与Ni2+配位的N原子有__________个,该配合物中存在的化学键有_________(填序号)。
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
(5)Ni与Fe的构型相同(体心立方堆积),Ni的摩尔质量为M g/mol,阿伏加德罗常数为NA,密度为a g/cm3Ni原子的半径为_________pm(金属小球刚性相切)
【答案】 [Ar]3d84s2 O NO+ 平面正方形 LaNi5 H+ 4 ACE ![]() ×
×![]() ×1010
×1010
【解析】(1)Ni的原子序数为28,根据构造原理可写出电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2;故答案为:1s22s22p63s23p63d84s2或[Ar]3d84s2;
(2)CO为分子,化合价为0,所以镍的化合价为0;CO含有2个原子14个电子,所以CO互为等电子体的带一个单位正电荷阳离子为NO+;Ni(CO)4的一氯代物有2种,说明空间构型为平面正方形,若为正四面体结构则一氯代物只有1种,故答案为:0;NO+;平面正方形;
(3)该晶胞中La原子个数=8×![]() =1,Ni原子个数=1+8×
=1,Ni原子个数=1+8×![]() =5,化学式为LaNi5(或Ni5La),故答案为:LaNi5(或Ni5La);
=5,化学式为LaNi5(或Ni5La),故答案为:LaNi5(或Ni5La);
(4)由质量守恒与电荷守恒可知,Ni2+![]() ═
═ +2H+;Ni含有空轨道、N原子含有孤电子对,所以配位键由N原子指向Ni原子,有4个配位键;该配合物中N-O中O原子和-OH中氢原子形成氢键,该配合物分子中配位键、氢键为
+2H+;Ni含有空轨道、N原子含有孤电子对,所以配位键由N原子指向Ni原子,有4个配位键;该配合物中N-O中O原子和-OH中氢原子形成氢键,该配合物分子中配位键、氢键为 ,除此之外还含有共价键;故答案为:H+;4;ACE;
,除此之外还含有共价键;故答案为:H+;4;ACE;
(5)该晶胞中,Ni原子个数=1+8×![]() =2,1mol晶胞的质量为2M g,设晶胞的边长为x cm,则a g/cm3=
=2,1mol晶胞的质量为2M g,设晶胞的边长为x cm,则a g/cm3=![]() ,解得x=
,解得x=![]() cm,设 Ni原子的半径为ycm,则(4y)2=x2+(
cm,设 Ni原子的半径为ycm,则(4y)2=x2+( ![]() )2,即(4y)2=(
)2,即(4y)2=(![]() )2+(
)2+(![]() ×
×![]() )2,解得y=
)2,解得y=![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010 pm,故答案为:
×1010 pm,故答案为: ![]() ×
×![]() ×1010。
×1010。


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g.cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓H2SO4;冷却至室温,搅拌下加入24gNaBr。
步骤2:如上图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12mLH2O、12mL5%Na2CO3溶液和12mLH2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
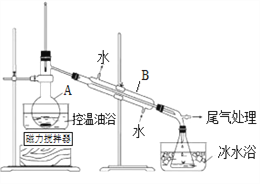
(1)仪器A、B的名称分别是____________________ 、______________________。
(2)反应时生成的主要有机副产物有_______________。(写出两种物质的结构简式)
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_____________。
(4)写出生成1-溴丙烷的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2在70℃的氢氧化钠溶液中,能同时发生2个自身氧化还原反应,完全反应后生成NaClO和NaClO3的物质的量比为4∶1,则溶液中NaCl和NaClO的物质的量之比为( )
A. 1∶1 B. 5∶1 C. 9∶4 D. 11∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的。
(1)基态E原子的价电子排布式为________________________;
(2)AB32-的立体构型是____________,其中A原子的杂化轨道类型是___________________________。
(3)A22-与B22+互为等电子体,B22+的电子式可表示为________________,1molB22+中含有的π键数目为________________________。
(4)用氢键表示式写出C的氢化物水溶液中存在的所有氢键___________________。
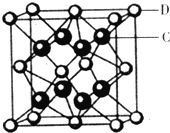
(5)化合物DC2的晶胞结构如图所示,该离子化合协晶体的密度为ag/cm3,则晶胞的体积是_________________(只要求列算式,阿伏加德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,正确的是
A. 同周期元素中,ⅦA族元素的原子半径最大
B. ⅥA族元素的原子,其半径越大,越容易得到电子
C. 室温时,0族元素的单质都是气体
D. 元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晚上,婷婷向爸妈介绍了自己学过的安全知识。以下说法不正确的是( )
A. 装修房屋时宜选用环保材料
B. 液化气罐漏气可用明火检验
C. 家用电器着火,应先关闭电源,再用二氧化碳灭火器灭火
D. 煤气热水器应安装在通风效果良好的地方,使用时保持通风
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com