
(12分)甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g) + 2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
①2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
②2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
(3)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置:
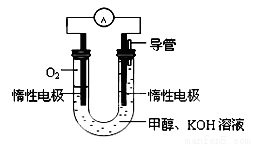
①工作一段时间后,测得溶液的pH减小。请写出该电池的负极的电极反应式。
②用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为 mol/L(假设电解前后溶液体积不变)。
(1)①< ②80% 250℃
(2)CH3OH(l)+O2(g) =CO(g)+2H2O(l) △H= - 442.8kJ/mol
(3) ①CH3OH-6e-+ 8OH- = CO32- + 6H2O ②0.2 mol/L
【解析】
试题分析:(1)①根据题给数据分析,平衡常数随温度升高而减小,平衡逆向进行,正反应是放热反应,△H<0;②某温度下,将2mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,依据化学平衡三段式列式计算;
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
起始浓度 1 3 0
变化浓度0.8 1.6 0.8
平衡浓度 0.2 1.4 0.8
CO的转化率=0.8/1×100%=80%;该反应的平衡常数K=0.8/(0.2×1.42)=2.041,温度为250℃;(2)反应① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(l) ΔH1=-1451.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
依据盖斯定律:①×1/2—②×1/2得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g) =CO(g)+2H2O(l) △H= - 442.8kJ/mol ;(3)①甲醇和氧气以氢氧化钾溶液为电解质溶液的燃料电池,甲醇在原电池负极发生氧化反应,甲醇失电子在碱溶液中生成碳酸钾,电极反应为:CH3OH-6e-+8OH-=CO32-+6H2O;(4)用该电池电解(惰性电极)500mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8g Cu(OH)2固体。根据铜原子守恒知,n(CuSO4)= n(Cu(OH)2)=9.8g/98g·mol—1=0.1mol,溶液的物质的量浓度为0.2 mol/L。
考点:考查化学平衡的计算、热化学方程式的书写和电化学。


科目:高中化学 来源:2014-2015湖南省高二上学期期中化学(文)试卷(解析版) 题型:选择题
在南方人们的主食是大米,在进食时,我们将米饭在嘴中长时间嚼为什么感觉到有甜味呢
A.淀粉在唾液淀粉酶的作用下转变成麦芽糖
B.淀粉中含有葡萄糖
C.淀粉在唾液淀粉酶的作用下转变成葡萄糖
D.淀粉是糖类物质有甜味
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
检验氯化氢中是否含有氯气,可采用的方法是
A.用干燥的蓝色石蕊试纸 B.用干燥的有色布条
C.将气体通入硝酸银溶液中 D.将气体通入品红溶液中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:填空题
选考[化学——选修3:物质结构与性质] (15分)
锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu的第三能层的电子排布式 ,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有 (填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 。
(2)PO43-的空间构型是 。
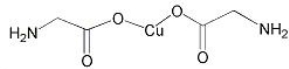
(3)氨基乙酸铜的分子结构如图,氮原子的杂化方式为 。
(4)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则CN-中含有的σ键与π键的数目之比为 。
(5)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式为 。
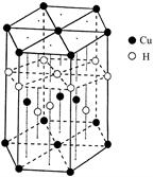
(6)铜晶体为面心立方最密堆积,铜的原子半径为r pm,则晶体铜密度的计算式为 g/cm3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32-
B.澄清的溶液中:Na+、K+、MnO4—、AlO2—
C. =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l), △H2
B.H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2
C.C(s)+1/2O2(g)=CO(g),△H1; C(s)+O2(g)=CO2(g), △H2
D.S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g), △H2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期10月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1mol二氧化硅晶体中含有4NA个硅氧键
B.100mL 18.4mo1·L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA
C.0.1L 3mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
D.将0.l mol FeC13滴入沸水中可制得0.1NA Fe(OH)3胶粒
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
向一定量的Cu、Fe2O3的混合物中加人600mL 2mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+,再加入过量1 mol/L NaOH溶液,将沉淀过滤、洗涤、干燥,称得质量比原混合物增重17.6g,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量是
A.4.8 g B.8.8 g C.9.6g D.14.4g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高密市高三12月检测理综化学试卷(解析版) 题型:选择题
下列所陈述的事实与解释均正确的是
选项 | 事实 | 解释 |
A | 用pH试纸测出新制氯水的pH为3 | 新制氯水有酸性 |
B | C2H5OH与浓硫酸共热170℃,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
C | 收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅 | 生成的红棕色NO2气体部分转化为无色气体 |
D | 甲苯能使酸性高锰酸钾溶液褪色 | 发生了萃取 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com