
下列液体均处于25 ℃,有关叙述正确的是( )。
A.某物质溶液的pH>7,则该物质一定是碱或强碱弱酸盐
B.pH=6.5的牛奶中c(H+)是pH=4.5的H2SO4溶液中c(H+)的100倍
C.pH=3的醋酸与pH=11的NaOH溶液等体积混合后溶液中:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.AgCl在等浓度的CaCl2溶液和NaCl溶液中的溶解度相同
C
【解析】 本题考查了溶液中离子浓度的大小比较、溶解度等知识,意在考查考生对电解质溶液、电离与水解平衡等知识的理解能力。碱性溶液可能是碱、强碱弱酸盐的溶液,也可能是弱酸弱碱盐的溶液,A项错。pH是溶液中H+浓度的负对数,pH相差2个单位,c(H+)相差100倍,pH=4.5的H2SO4溶液中c(H+)是pH=6.5的牛奶中c(H+)的100倍,B项错。pH=3的醋酸溶液的物质的量浓度大于pH=11的NaOH溶液的物质的量浓度,两者等体积混合时醋酸过量,溶液呈酸性,溶液中各离子浓度关系正确,C正确;溶液中Cl-浓度影响AgCl的溶解度,等浓度的CaCl2溶液和NaCl溶液中Cl-浓度不同,AgCl的溶解度不同,D项错。


科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第1讲物质组成性质分类练习卷(解析版) 题型:选择题
下列有关物质分类一定正确的是( )。
①强电解质:氯化氢、氢氧化钡、摩尔盐 ②弱电解质:草酸、纯碱、醋酸铵 ③非电解质:液氨、二氧化硫、苯 ④同系物:CH2O2、C2H4O2、C3H6O2
A.①②③ B.①③ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题9常见金属元素及其重要化合物练习卷(解析版) 题型:填空题
下列转化关系中,X、Y是生活中用途广泛的两种金属单质,A、B是氧化物,A呈红棕色,C、D、E是中学常见的三种化合物。分析转化关系回答问题:

(1)请写出反应①的化学方程式_____________________________________。
(2)检验D溶液中Y离子的方法是__________________________________。
(3)若试剂a是NaOH溶液,写出单质X与NaOH溶液反应的离子方程式______________________________。
(4)若试剂b是H2SO4,工业上用E、H2SO4和NaNO2为原料制取高效净水剂Y(OH)SO4,已知还原产物为NO,则该反应的化学方程式是________________________________________。
(5)工业上电解熔融的B制取X时,若阳极产生的气体在标准状况下的体积为33.6 m3,则阴极产物的质量为________kg。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题8电化学原理练习卷(解析版) 题型:选择题
利用如图装置可以模拟铁的电化学防护。下列叙述正确的是 ( )。

A.铁被腐蚀过程实质是金属铁发生了还原反应
B.若X为锌片,开关K置于M处,可减缓铁的腐蚀
C.若X为碳棒,开关K置于M处,可减缓铁的腐蚀
D.当K置于N处时,可减缓铁的腐蚀
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题7电解质溶液练习卷(解析版) 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题6化学反应速率和化学平衡练习卷(解析版) 题型:填空题
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1。该反应可用于消除氮氧化物的污染。在130 ℃和180 ℃时,分别将0.50 mol CH4和a mol NO2充入1 L的密闭容器中发生反应,测得有关数据如下表:
实验 编号 | 温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
1 | 130 ℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
2 | 180 ℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 |
| 0.15 |
(1)开展实验1和实验2的目的是______________________________。
(2)180 ℃时,反应到40 min,体系________(填“是”或“否”)达到平衡状态,理由是__________________________;
CH4的平衡转化率为________。
(3)已知130 ℃时该反应的化学平衡常数为6.4,试计算a的值。(写出计算过程)
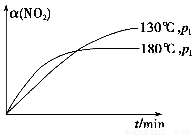
(4)一定条件下,反应时间t与转化率α(NO2)的关系如图所示,请在图像中画出180 ℃时,压强为p2(设压强p2>p1)的变化曲线,并做必要的标注。
(5)根据已知求算:ΔH2=________。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH2
2N2(g)+CO2(g)+2H2O(g) ΔH2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题6化学反应速率和化学平衡练习卷(解析版) 题型:选择题
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是 ( )。
2Z(g)一定达到化学平衡状态的是 ( )。
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
A.①② B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题4物质结构与元素周期律练习卷(解析版) 题型:填空题
A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大。已知:A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物与其氢化物反应能生成盐,D与E同主族,E元素原子的最外层电子数比次外层电子数少2。请回答:
(1)元素C在周期表中的位置是________。
(2)元素D的单质与金属钠反应生成的化合物可作潜水面具中的供氧剂,这种化合物与水反应的离子方程式________________________________。
(3)D和E两种元素相比较,其原子得电子能力较强的是________(写名称)。
以下说法中,可以证明上述结论的是__________(填写编号)。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素氢化物的水溶液的酸性
(4)元素A、D、E与钠元素可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中反应的离子方程式是____________________________。
(5)由元素A、B、D组成的一元酸X为日常生活中的调味剂,元素A、F组成的化合物为Y。在等体积、等pH的X、Y的溶液中分别加入等质量的锌粉,反应后若最后仅有一份溶液中存在锌粉,则反应过程中两溶液中反应速率的大小关系是:X________Y(填“>”、“=”或“<”)。
(6)元素F的单质常温下是一种气体,工业上主要是通过电解其钠盐的饱和溶液的方法获得该气体,假定装入的饱和溶液为100 mL(电解前后溶液体积变化可忽略),当测得阴极上产生11.2 mL(标准状况)气体时停止通电,将溶液摇匀,此时溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题2常用化学计量--物质的量练习卷(解析版) 题型:选择题
以下仪器,用蒸馏水洗净后便可立即使用而不会对实验结果造成误差的是( )。
①中和滴定用的锥形瓶 ②中和滴定用的滴定管 ③容量瓶 ④配制一定体积、一定物质的量浓度的NaOH溶液,用于称量的小烧杯 ⑤量筒(量取浓H2SO4)
A.①②⑤ B.①③ C.②④⑤ D.①⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com