C
分析:A、依据形成共价键是共用电子形成的实质,结合分子结构计算;
B、依据NaHSO
4溶液中HSO
4-完全电离分析判断;
C、依据气体摩尔体积的条件应用,结合CO
2和O
3的分子中含有的原子数相同分析;
D、质量换算物质的量,结合过氧化氢分解的氧化还原反应的电子转移分析计算.
解答:A、共价键是以共用电子对形成,所以0.1molPCl
3中形成共价键为3各共价键,所含的电子数是0.6N
A,故A错误;
B、100mL1mol/LNaHSO
4溶液中HSO
4-离子在中学阶段是完全电离成硫酸根离子和氢离子,不存在硫酸氢根离子,故B错误;
C、标准状况下,11.2LCO
2和O
3混合气体物质的量为0.5mol,因为二氧化碳分子和臭氧分子中的原子数相同,所以0.5molCO
2和O
3混合气体中含有的原子数是1.5N
A,故C正确;
D、17gH
2O
2物质的量=
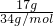
=0.5mol,完全分解的化学方程式为:2H
2O
2=2H
2O+O
2↑,2molH
2O
2分解O元素的化合价从-1价变化为0价和-2价,电子转移数为2mol,所以0.5mol过氧化氢分解电子转移为0.5mol,即0.5N
A,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要考查共价键的实质,硫酸氢根离子在溶液中的存在形式,气体摩尔体积的条件应用,氧化还原反应的电子转移计算.

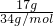 =0.5mol,完全分解的化学方程式为:2H2O2=2H2O+O2↑,2molH2O2分解O元素的化合价从-1价变化为0价和-2价,电子转移数为2mol,所以0.5mol过氧化氢分解电子转移为0.5mol,即0.5NA,故D错误;
=0.5mol,完全分解的化学方程式为:2H2O2=2H2O+O2↑,2molH2O2分解O元素的化合价从-1价变化为0价和-2价,电子转移数为2mol,所以0.5mol过氧化氢分解电子转移为0.5mol,即0.5NA,故D错误;

 阅读快车系列答案
阅读快车系列答案