
【题目】有机物W在工业上常用作溶剂和香料,其合成方法如下:

下列说法正确的是
A. M、N、W均能发生加成反应、取代反应
B. N、W组成上相差一个CH2原子团,所以互为同系物
C. W属于脂肪,能发生皂化反应
D. M的二氯代物有8种
【答案】A
【解析】
甲苯被氧化生成苯甲酸,苯甲酸与甲醇发生酯化反应可生成苯甲酸甲酯。
A.都含有苯环,可发生加成反应,苯环、甲基可发生取代反应,羧基可发生酯化反应,酯基可发生水解反应;
B.N、W含有的官能团不同;
C.油脂在碱性条件下的水解为皂化反应;
D.M的二氯代物,两个Cl原子可在甲基、苯环上,结合位置异构判断。
A.含有苯环,都可发生加成反应,苯环、甲基可发生取代反应,羧基可发生酯化反应,酯基可发生水解反应,水解反应也就是酯的取代反应,A正确;
B.N、W组成上相差一个CH2原子团,但是它们含有的官能团不同,即结构不同,因此不属于同系物,B错误;
C.油脂在碱性条件下的水解为皂化反应,而W是酯,但不是油脂,所以它的水解不是皂化反应,C错误;
D.若取代甲基上的2个H原子,有1种结构;若取代甲基上1个H原子、苯环上1个H原子,则苯环上的Cl原子相对甲基有邻、间、对3种结构;若全部取代苯环上的2个H原子,若其中1个Cl原子与甲基相邻,另一个Cl原子有如图所示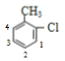 四种取代位置,有4种结构,若其中1个Cl原子处于甲基间位,另一个Cl原子有如图所示
四种取代位置,有4种结构,若其中1个Cl原子处于甲基间位,另一个Cl原子有如图所示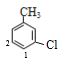 2种取代位置,有2种结构,故甲苯的二氯代物共有1+3+4+2=10种,D错误。
2种取代位置,有2种结构,故甲苯的二氯代物共有1+3+4+2=10种,D错误。
故合理选项是A。


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室常用MnO2 与浓盐酸反应制备Cl2(装置如图所示)。

(1)制备实验开始时,先检査装置气密性,接下来的操作依次是:________(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
(2)写出圆底烧瓶中发生反应的离子方程式___________________。
(3)制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法________(填编号)。
a.将Cl-转化为AgCl沉淀,过滤,洗涤,干燥,称量沉淀的质量
b.与足量NaHCO3固体反应,将反应后气体直接用碱石灰吸收,测定生成的气体的质量
c.与足量锌反应,测量生成气体标准状况下的体积
Ⅱ. 为测定某亚硫酸钠样品纯度,研究小组利用如下装置(装置图中夹持仪器已省略)进行实验。反应完全后,取C中溶液,加入过量BaCl2溶液,过滤、 操作① 、干燥、称量,利用所得数据计算样品纯度。请回答:

(1)操作①的名称是_________。
(2)装置B的作用是_________。
(3)上述实验测得的样品纯度比实际偏低,为提高测定结果的准确度,针对装置可采取的改进措施是____________________(写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】扁桃酸衍生物是重要的医药中间体,以A和B为原料合成扁桃酸衍生物F的路线如下:

(1)A分子式为C2H2O3,可发生银镜反应,且具有酸性,A所含官能团名称为__________,写出A+B→C的化学反应方程式:____________。
(2)E是由2分子C生成的含有3个六元环的化合物,E分子中不同化学环境的氢原子有____种。
(3)D→F的反应类型是______,写出符合下列条件的F的所有同分异构体(不考虑立体异构)的结构简式:__________________。
①属于一元羧酸类化合物②苯环上只有2个取代基且处于对位,其中一个是羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表第四周期Ⅷ族,其基态原子中未成对电子个数为___________。
(2)基态Fe3+的核外电子排布式___________
(3)铁氧体是一种磁性材料,工业上制备时常采用水解法,制备时常加入尿素(CO(NH2)2)、醋酸钠等碱性物质。尿素分子中所含非金属元素的电负性由大到小的顺序是___________,分子中σ键与π键的数目之比为___________。醋酸钠中碳原子的杂化类型___________。
(4)铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱,已知氨(NH3熔点:-77.8%℃、沸点:-33.5%℃),联氨(N2H4熔点:2℃、沸点:113.5°C)解释其熔沸点高低的主要原因______________________。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,已知Co3+的配位数为6,为确定钻的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,则第一种配合物的配体为___________。在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________。

(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如上图所示,则该物质的化学式为___________。若品体密度为dg·cm-3,则晶胞中最近的两个碳原子的距离为___________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值。下列说法正确的是
A. 标准状况下,11.2LH2与11.2LD2所含的中子数均为NA
B. 1L0.1 mol/L FeCl3溶液中含Fe3+数目为0.1NA
C. 6.4gCu与3.2gO2隔绝空气加热,充分反应后,转移电子数为0.2NA
D. 0.1mol乙醇与0.1mol乙酸在浓硫酸催化并加热下,生成的乙酸乙酯为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出的对晶体的说明中,错误的是( )
选项 | A | B | C | D |
晶体名称 | 碘化钾 | 干冰 | 二氧化硅 | 碘 |
晶体中的粒子 | 阴、阳离子 | 分子 | 原子 | 分子 |
粒子间的作用 | 离子键 | 分子间的作用力 | 共价键 | 共价键 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4的工艺流程如下:

下列说法正确的是
A.通入NH3和CO2的顺序可以颠倒
B.操作1为过滤,操作2为蒸馏
C.通入的NH3和CO2均应过量,且工艺流程中CO2可循环利用
D.步骤②中反应的离子方程式为CaSO4+2NH3+CO2+H2O=CaCO3↓+2NH4++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国某科研团队以N2为原料合成了超高含能材料聚合氮——以氮氮单键(N-N)结合的具有网状结构的聚合体。有关化学键的键能数据如下:
化学键 | N≡N | N=N | N-N |
键能/(kJ/mol) | 946 | 419 | 159 |
下列分析不正确的是
A. 氮原子的结构示意图:![]() B. 聚合氮转变为N2会释放能量
B. 聚合氮转变为N2会释放能量
C. 高温有利于聚合氮的合成 D. 低压有利于聚合氮的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各方程式中,属于水解反应的是( )
A. HCO3—+H2O![]() H2CO3+OH- B. HCO3—+H2O
H2CO3+OH- B. HCO3—+H2O![]() CO32—+H3O+
CO32—+H3O+
C. HCO3—+OH-=CO32-+H2O D. CO32-+H+=HCO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com