
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.![]() 中含有的
中含有的![]() 键数目为
键数目为![]()
B.标况下![]() 的
的![]() 分子,含共用电子对数
分子,含共用电子对数![]()
C.![]() 分别与足量的
分别与足量的![]() 和
和![]() 充分反应后转移的电子数均为
充分反应后转移的电子数均为![]()
D.![]() 的盐酸与氨水混合后溶液呈中性,则
的盐酸与氨水混合后溶液呈中性,则![]()
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2),并将Cl2依次通入NaBr溶液和KI-淀粉溶液中。如图所示仪器及药品,试回答:
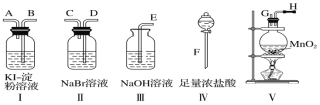
(1)若所制取气体的流向从左向右时,上述仪器接口的连接顺序为____接_____、 ____接____、________接____、_____接____(填字母)。
(2)实验开始后装置Ⅴ中反应的离子方程式为________。
(3)装置Ⅱ中发生的现象是_______,反应的化学方程式为_____。
(4)装置Ⅰ中产生的现象:溶液先变蓝一段时间后蓝色褪去,生成两种强酸,请写出蓝色褪去的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向50.00mL未知浓度的氨水中逐滴加入0.5mol·L-1的HC1溶液。滴定过程中,溶液的pOH[pOH=-lgc(OH-)]与滴入HCl溶液体积的关系如图所示,则下列说法中正确的是
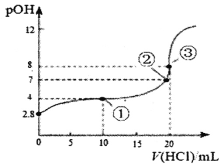
A. 图中②点所示溶液的导电能力弱于①点
B. ③点处水电离出的c(H+)=1×10-8mol·L-1
C. 图中点①所示溶液中,c(C1-)>c(NH4+)>c(OH-)>c(H+)
D. 25℃时氨水的Kb约为5×10-5.6mo1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂![]() 主要成分为
主要成分为 ![]() ,某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
,某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
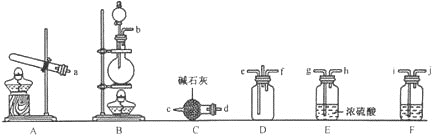
(1)岩脑砂的制备
![]() 利用装置A制取实验所需的氨气,写出反应的化学方程式:_____________。
利用装置A制取实验所需的氨气,写出反应的化学方程式:_____________。
![]() 该实验中用浓盐酸与
该实验中用浓盐酸与![]() 反应制取所需氯气,则装罝F中的试剂是
反应制取所需氯气,则装罝F中的试剂是![]() 填写试剂名称
填写试剂名称![]() ___________________。
___________________。
![]() 为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:
为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:![]() _____
_____![]() ________
________![]() 提示:氨气和氯气形成逆向流动,更有利于二者充分混合
提示:氨气和氯气形成逆向流动,更有利于二者充分混合![]()
![]() 证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀
证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀![]() 、NaOH溶液外,还需要____________________。
、NaOH溶液外,还需要____________________。
(2)岩脑砂中元素的测定
准确称取![]() 岩脑砂,与足量的氧化铜混合加热
岩脑砂,与足量的氧化铜混合加热![]() 发生的反应为
发生的反应为![]() ,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
,利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
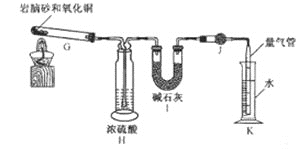
![]() 设置装置H的目的是____________________。
设置装置H的目的是____________________。
![]() 若装置Ⅰ增重
若装置Ⅰ增重 ![]() ,利用装置 K测得气体体积为
,利用装置 K测得气体体积为 ![]() 已知常温常压下气体摩尔体积为
已知常温常压下气体摩尔体积为 ![]() ,则岩脑砂中
,则岩脑砂中 ![]() _____________
_____________![]() 用含 b、V的代数式表示,不必化简
用含 b、V的代数式表示,不必化简![]() 。若测量体积时气体温度高于常温
。若测量体积时气体温度高于常温![]() 其他操作均正确
其他操作均正确![]() ,则
,则 ![]() 比正常值______________
比正常值______________![]() 填“偏高”“偏低”或“无影响”
填“偏高”“偏低”或“无影响”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢![]() 是一种有大蒜气味的、无色剧毒的强还原性气体,易在空气中自燃,一般在稀释状态下使用能降低风险。某科研小组拟用水解法制备并冷凝收集部分干燥的
是一种有大蒜气味的、无色剧毒的强还原性气体,易在空气中自燃,一般在稀释状态下使用能降低风险。某科研小组拟用水解法制备并冷凝收集部分干燥的![]() ,再利用未液化的余气继续探究其热分解情况。实验装置图及编号如下
,再利用未液化的余气继续探究其热分解情况。实验装置图及编号如下![]() 导管和部分夹持装置省略
导管和部分夹持装置省略![]() ,其中装置D是鼓泡器,用于监测
,其中装置D是鼓泡器,用于监测![]() 的流速。
的流速。
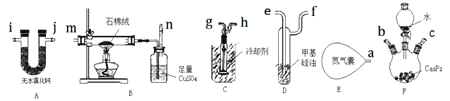
(1)写出![]() 水解法制备
水解法制备![]() 的化学反应方程式________。由于
的化学反应方程式________。由于![]() 水解反应太剧烈,为了减缓反应速率实验室可用________代替水。
水解反应太剧烈,为了减缓反应速率实验室可用________代替水。
(2)实验装置接口的正确连接顺序为![]() ________
________![]() 。
。
(3)![]() 中盛装石棉绒的仪器名称是________;装置E中装有足量的
中盛装石棉绒的仪器名称是________;装置E中装有足量的![]() ,实验中需持续通入后续装置,其作用主要有________
,实验中需持续通入后续装置,其作用主要有________![]() 答两点即可
答两点即可![]() 。
。
(4)![]() 中反应一段时间后,出现白色蜡状固体,经检验为白磷
中反应一段时间后,出现白色蜡状固体,经检验为白磷![]() 。写出该反应的化学方程式________。
。写出该反应的化学方程式________。
(5)在![]() 溶液吸收未反应的
溶液吸收未反应的![]() 气体过程中,产生
气体过程中,产生![]() 和两种常见的最高价含氧酸,反应化学方程式为________;已知
和两种常见的最高价含氧酸,反应化学方程式为________;已知![]() 足量时,
足量时,![]() 可继续被还原生成Cu单质。该小组为了测定此次制备
可继续被还原生成Cu单质。该小组为了测定此次制备![]() 的体积分数,收集到A装置出口的气体体积为
的体积分数,收集到A装置出口的气体体积为![]() 已折算为标准状况
已折算为标准状况![]() ,刚好被
,刚好被![]() 的
的![]() 溶液完全吸收,经过滤、洗涤、干燥后,得到
溶液完全吸收,经过滤、洗涤、干燥后,得到![]() 单质,则
单质,则![]() 的体积分数为________。
的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验室用下图所示装置制备高浓度的次氯酸,先在Ⅱ中生成![]() ,再在Ⅲ中得到HClO溶液。
,再在Ⅲ中得到HClO溶液。
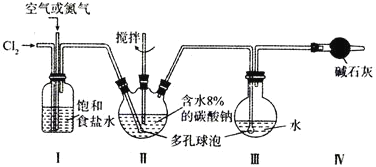
已知:![]() 的沸点为
的沸点为![]() ,
,![]() 以上分解为
以上分解为![]() 和
和![]() ;
;![]() 极易溶于水并与水反应生成HClO。
极易溶于水并与水反应生成HClO。
(1)反应中通入空气或氮气的作用是________________,实验中控制氯气与空气或氮气的体积比的方法是_________。
(2)装置Ⅱ、Ⅲ中使用多孔球泡的作用是_________;装置Ⅱ中发生反应的化学方程式为_________。
(3)反应时,Ⅱ中要加装冷却装置,其原因是__________。
(4)已知次氯酸可被![]() 还原成
还原成![]() ,可利用此原理测定Ⅲ中所得次氯酸溶液的物质的量浓度。
,可利用此原理测定Ⅲ中所得次氯酸溶液的物质的量浓度。
![]() 此反应的化学方程式为__________________________。
此反应的化学方程式为__________________________。
![]() 量取
量取![]() 次氯酸溶液于烧杯中,加入足量的
次氯酸溶液于烧杯中,加入足量的![]() 溶液,混合均匀后再加入足量的
溶液,混合均匀后再加入足量的![]() 溶液,反应完全后过滤,洗涤,干燥,用电子天平称量,得到固体
溶液,反应完全后过滤,洗涤,干燥,用电子天平称量,得到固体![]() ,则所制取次氯酸的浓度为______
,则所制取次氯酸的浓度为______![]() 。
。
(5)若制得上述次氯酸溶液![]() ,转化过程中氯的损耗为
,转化过程中氯的损耗为![]() ,则至少需要标况下
,则至少需要标况下![]() __________L。
__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出以乙炔为原料制备![]() (聚氯乙烯)的过程中所发生的反应类型:____________、_____________。
(聚氯乙烯)的过程中所发生的反应类型:____________、_____________。![]() (聚乙烯)材料目前被公认为安全材料,也可用于制作保鲜膜和一次性餐盒。辨别
(聚乙烯)材料目前被公认为安全材料,也可用于制作保鲜膜和一次性餐盒。辨别![]() 和
和![]() 有三种方法,一是闻气味法:具有刺激性气味的是___________________;二是测密度法:密度大的应是___________________;三是燃烧法:
有三种方法,一是闻气味法:具有刺激性气味的是___________________;二是测密度法:密度大的应是___________________;三是燃烧法:![]() 的单体和
的单体和![]() 的单体在足量空气中燃烧的实验现象的明显区别是__________。
的单体在足量空气中燃烧的实验现象的明显区别是__________。
(2)![]() (
(![]() )是一种阻隔性高、韧性强、化学稳定性好的理想包装材料,广泛用于肉制品、豆制品等的包装。写出合成
)是一种阻隔性高、韧性强、化学稳定性好的理想包装材料,广泛用于肉制品、豆制品等的包装。写出合成![]() 的单体的同分异构体的结构简式_________。
的单体的同分异构体的结构简式_________。
(3) “白色污染”是指各种塑料制品对环境的污染。焚烧塑料会生成有毒物质二噁英,二噁英是含有如图所示母体的系列化合物,下列关于如图所示物质的说法不正确的是___________________(填序号)。

a.该物质在氧气中完全燃烧的产物是![]() 和
和![]()
b.该物质属于烃
c.该物质的一卤代物只有2种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com