
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
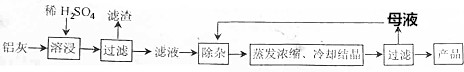
分析 Al2O3、SiO2和少量FeO•xFe2O3$\stackrel{稀硫酸}{→}$$\left\{\begin{array}{l}{滤液:硫酸铝、硫酸铁、硫酸亚铁}\\{滤渣:二氧化硅}\end{array}\right.$$\stackrel{过滤}{→}$Al2(SO4)3、FeSO4、Fe2(SO4)3$\stackrel{调节pH1.5-2.8}{→}$让铁离子沉淀完全,得到Al2(SO4)3溶液,再蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得Al2(SO4)3•18H2O.
(1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,硫酸溶解氧化铝生成硫酸铝和水;
(2)三价铁离子遇到硫氰酸根离子会呈现红色,据此检验铁离子;
(3)①MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,结合电子、电荷守恒及原子守恒分析;
②铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
③向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水;
④MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去.
(4)由元素守恒可知,母液中存在较多的K+、SO42-.
解答 解:(1)Al2O3、FeO•xFe2O3能与硫酸反应,而SiO2不与硫酸反应,步骤Ⅰ过滤得到沉淀的主要成分为:SiO2,硫酸溶解氧化铝生成硫酸铝和水,反应的离子方程式为:Al2O3+6H+=2Al3++3H2O,
故答案为:SiO2;Al2O3+6H+=2Al3++3H2O;
(2)三价铁离子遇到硫氰酸根离子会呈现红色,Fe3++3SCN-?Fe(SCN)3溶液,取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+,
故答案为:取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,反之,溶液不变红色,说明滤液中不含Fe3+;
(3)①MnO4-氧化Fe2+,Mn元素的化合价由+7价降低为+2价,Fe元素的化合价由+2价升高为+3价,由电子、电荷守恒及原子守恒可知,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
故答案为:5;8H+;5;4H2O;
②铁离子开始沉淀和沉淀完全的溶液pH为1.5~2.8,铝离子开始沉淀pH为3.4,亚铁离子开始沉淀的溶液pH大于铝离子完全沉淀pH,向滤液中加入过量KMnO4溶液,目的是氧化亚铁离子为三价铁离子,依据图表数据分析可知,所以调节溶液的pH约为3,可以使铁离子全部沉淀,铝离子不沉淀分离;
故答案为:pH约为3时,Fe2+和Al3+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀;
③向Ⅲ的沉淀中加入浓HCl并加热,二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,生成的氯气是黄绿色气体,能说明沉淀中存在MnO2,
故答案为:生成黄绿色气体;MnO2+4HCl(浓$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
④MnO4-可与Mn2+反应生成MnO2,过滤除去,所以可以利用MnSO4的溶液和高锰酸钾溶液反应生成二氧化锰,把过量高锰酸根离子除去.
故答案为:除去过量的MnO4-;
(4)反应后,溶液中存在较多的K+、SO42-便留在母液中,可回收的主要物质为K2SO4,
故答案为:K2SO4.
点评 本题考查实验制备方案,侧重考查学生对原理及操作的分析评价、对数据的分析运用、物质的分离提纯等,需要学生具备知识的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| W | X | Y | |
| Z |
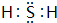 .
.
| 编号 | 性质推测 | 化学方程式 |
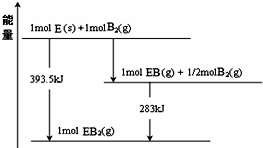
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+3H2O |
| ① | 还原性 | |
| ② | H2ZO3+2NaOH═Na2ZO3+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se是同一种核素 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se分别含有44和46个质子 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se都含有34个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 解释或结论 |
| A | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 该溶液中含Na+、不含K+ |
| B | 向某溶液中滴加KSCN溶液,无明显现象,再滴加少量氯水,溶液变成血红色 | 溶液中含有Fe2+、没有Fe3+ |
| C | 向苯中滴入少量浓溴水、振荡,静置,溶液分层,上层呈橙红色,下层几乎无色 | 苯和溴水发生取代反应,使溴水褪色 |
| D | 在少量无水乙醇中加入金属Na,缓慢生成可以在空气中燃烧的气体 | CH3CH2OH是弱电解质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
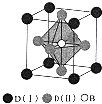 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中离子数目增加,导电性增强 | |
| B. | 加水促进醋酸电离,但[H+]、[OH-]均减小 | |
| C. | 加水稀释到1000 mL,溶液的pH=5 | |
| D. | $\frac{[C{H}_{3}CO{O}^{-}]}{[C{H}_{3}COOH]}$增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com