
| A.0.8~2mol/L | B.0~2mol/L | C.0~0.8mol/L | D.无法确定 |
科目:高中化学 来源: 题型:阅读理解
 ),有关反应如下:
),有关反应如下:| c2(NO2) |
| C2(NO)c(O2) |
| c2(NO2) |
| C2(NO)c(O2) |


查看答案和解析>>
科目:高中化学 来源: 题型:
 二甲基亚砜
二甲基亚砜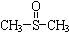 有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜(
有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜( ),有关反应如下:
),有关反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)二甲基亚砜有消炎止痛、镇静等作用。甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3—S—CH3),甲硫醚再与NO2反应制取二甲基亚砜 ( ),有关反应如下:
反应① 2CH3OH(l)+H2S(g)=(CH3)2S(l) +2H2O(l) △H=―akJ·mol-1
反应② (CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g) △H=-bkJ··mol-1
反应③ 2NO(g)+O2(g)=2NO2(g) △H=-ckJ·mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
___________________________________________________,
![]() (2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________。
(2)能说明反应2CH3OH(l)+H2S(g) (CH3)2S(l) +2H2O(l)达平衡状态的是____________。
A. v(CH3OH) =2v(H2S)
B. 恒容容器中,体系的压强不再改变
C. 恒容容器中,体系中气体的密度不再改变
D. 恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K= ____________________。
(4)N2O5是一种新型绿色硝化剂,其制备方法有以下两种。
方法一:4NO2(g)+O2(g) =2N2O5(g);△H=-56.76KJ·mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S __________ 0(填“>、<”或“=”)
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5。工作原理如下图:
硼氢化钠燃料电池的正极反应式________________________。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省苏锡常镇四市高三调研测试(一)化学试卷 题型:填空题
(10分)二甲基亚砜有消炎止痛、镇静等作用。甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫醚(CH3—S—CH3),甲硫醚再与NO2反应制取二甲基亚砜 ( ),有关反应如下:
),有关反应如下:
反应① 2CH3OH(l)+H2S(g)=(CH3)2S(l) +2H2O(l) △H=―akJ·mol-1
反应② (CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g) △H=-bkJ··mol-1
反应③ 2NO(g)+O2(g)=2NO2(g) △H=-ckJ·mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
___________________________________________________,
 (2)能说明反应2CH3OH(l)+H2S(g)
(CH3)2S(l) +2H2O(l)达平衡状态的是____________
。
(2)能说明反应2CH3OH(l)+H2S(g)
(CH3)2S(l) +2H2O(l)达平衡状态的是____________
。
A. v(CH3OH) = 2v(H2S)
B. 恒容容器中,体系的压强不再改变
C. 恒容容器中,体系中气体的密度不再改变
D. 恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K= ____________________。
(4)N2O5是一种新型绿色硝化剂,其制备方法有以下两种。
方法一:4NO2(g)+O2(g) =2N2O5(g); △H=-56.76 KJ·mol-1 [来源:学#科#网Z#X#X#K]
常温下,该反应能逆向自发进行,则逆向反应的△S __________ 0(填“>、<”或“=”)
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5。工作原理如下图:

硼氢化钠燃料电池的正极反应式________________________。
查看答案和解析>>
科目:高中化学 来源:2013届河南省濮阳市高二上学期期末考试化学试卷 题型:填空题
(16分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g)
△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g)
△H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是 ;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是 。
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO (g)
(g)  2CO(g)平衡常数K的表达式为
;
2CO(g)平衡常数K的表达式为
;
已知C(s)+H 0(g)t
0(g)t CO(g)+H
CO(g)+H (g)的平衡常数为K1;H
(g)的平衡常数为K1;H (g)+CO
(g)+CO (g)
(g)  C0(g)
C0(g)
+H 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K 与K
与K 、K
、K 二者的关系为
。
二者的关系为
。
(3)已知某温度下,反应2SO +0
+0
 2S0
2S0 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO )=lmol·L
)=lmol·L c0(O
c0(O )=1mol·L
)=1mol·L ,当反应在该温度下SO
,当反应在该温度下SO 转化率
转化率
为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g)  cC(g)+riD(g)△H=
cC(g)+riD(g)△H= kJ·mol
kJ·mol ;若
;若 +b>
+b>
c+d,增大压强平衡向 (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则 0(填“>”或“<”)。
0(填“>”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com