
| A. | 复方氢氧化铝有中和胃酸、解痉止痛的作用,胃痛、胃酸过多的患者可大量服用 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 天然存在的动植物油脂几乎都是混合物,没有固定的熔沸点 | |
| D. | 硫化氢是空气污染物,有臭鸡蛋气味,有剧毒 |
分析 A.药物过量服用会产生副作用;
B.食盐具有咸味,食盐能够使细菌脱水死亡,达到抑制细菌繁殖的目的;
C.天然油脂是混合物,没有固定的熔点和沸点;
D.硫化氢有毒,有臭鸡蛋气味.
解答 解:A.氢氧化铝与盐酸反应,可治疗胃酸过多,长期大剂量服用可致严重便秘,老年人长期服用可致骨质疏松以及智力障碍,故A错误;
B.食盐具有咸味,可做调味剂,食盐能够使细菌脱水死亡,达到抑制细菌繁殖的目的,可作防腐剂,故B正确;
C.天然油脂是由多种高级脂肪酸甘油酯构成的混合物,没有固定的熔沸点,故C正确;
D.硫化氢有臭鸡蛋气味,有剧毒,会污染空气,故D正确;
故选A.
点评 本题考查物质的组成和性质,为高频考点,把握物质的性质、性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| B. | 2molNO和1molO2在密闭容器中充分反应,反应后容器中的分子数小于2NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| D. | 1molNa与O2完全反应.生成Na2O和Na2O2的混合物,转移电子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第17列为卤族元素 | |
| B. | 第9列元素中没有非金属元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂、蛋白质都是天然高分子化合物,一定条件下都能水解 | |
| B. | 甲苯(C7H8)和甘油(C3H8O3)混合物,当总质量一定时,随$\frac{n(C{{\;}_{7}H}_{8})}{n({C}_{3}{H}_{8}{O}_{3})}$比值增大,完全燃烧耗氧量和生成水的量都增大 | |
| C. | 分子式为C5H10O2的有机物中能与NaOH溶液反应的有13种 | |
| D. | 某烃的结构简式可表示为  (碳原子数≤12),已知烃分子中有两种化学环境不同的氢原子,且数目之比为3:2,则该烃一定是苯的同系物 (碳原子数≤12),已知烃分子中有两种化学环境不同的氢原子,且数目之比为3:2,则该烃一定是苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 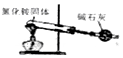 实验室用如图装置来制取NH3 | B. | 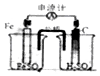 实验如图碳棒上有无色气泡产生 | ||
| C. | 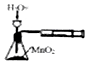 实验如图定量测定H2O2的分解速率 | D. |  实验如图检验钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,纯水的电离度为10-7×100% | |
| B. | 不能用溴水区分生物柴油和汽油 | |
| C. | 海水淡化可使用冷冻法、离子交换法、电解法、反渗透法、明矾吸附法 | |
| D. | 开发,有利于节省化石燃料,并减少温室效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是SiO2,太阳能电池的主要成分是单质硅 | |
| B. | 墨水是一种胶体,不同墨水混用时可能使铭笔流水不畅或者堵塞 | |
| C. | 食品包装袋内常用硅胶、生石灰和还原铁粉,其作用相同 | |
| D. | 用铝制容器盛装浓硫酸的原因是其表面发生钝化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑥⑦ | B. | ①③⑤ | C. | ①②④ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com