
科目:高中化学 来源:不详 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| W | 周期表中原子半径最小的元素 |
| U | 地壳中含量最多的金属元素 |
| R | 单质为空气的主要成分 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
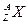 ,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.此元素有三种同位素 |
| B.其中一种同位素质量数为80 |
| C.其中质量数为79的同位素原子占原子总数的1/3 |
| D.此元素的单质的平均式量为160 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制备催化剂的元素 | B.耐高温的合金元素 |
| C.制备农药的元素 | D.用于半导体材料的元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ,形成的气态氢化物最稳定的元素是 。
,形成的气态氢化物最稳定的元素是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com