
下列反应起了氮的固定作用的是( )
A.N2和H2在一定条件下反应生成NH3
B.NH3经催化氧化生成NO
C.NO和O2反应生成NO2
D.由NH3制碳铵或氯铵
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
下列说法正确的是
A.已知Ksp[Fe(OH)3]=4.0×10—38,则常温下Fe3++3H2O Fe(OH)3+3H+的平衡常数K=2.5×10—5
Fe(OH)3+3H+的平衡常数K=2.5×10—5
B.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L—1的NaOH标准溶液
C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等
D.催化剂通过降低化学反应的焓变加快化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
A.Na+、K+、Cl-、SO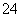 B.Cu2+、Fe2+、NO
B.Cu2+、Fe2+、NO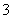 、SO
、SO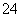
C.Na+、Ca2+、Cl-、ClO- D.K+、NH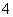 、Cl-、SO
、Cl-、SO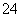
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是( )
A.Na+、K+、Cl-、SO B.Cu2+、Fe2+、NO
B.Cu2+、Fe2+、NO 、SO
、SO
C.Na+、Ca2+、Cl-、ClO- D.K+、NH 、Cl-、SO
、Cl-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
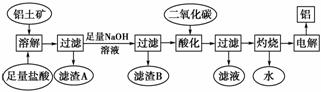
已知: 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;回答下列问题:
(1)向铝土矿中加入足量盐酸过滤后所得滤渣A的主要成分为________。
(2)在工艺流程中,加入足量氢氧化钠溶液过程中发生反应的离子方程式为__________________________________________________________________________,
过滤后所得滤渣B的成分为________。用二氧化碳酸化后过滤所得滤液中的溶质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸、硝酸与盐酸是工业上常用的三大强酸。工业上制备硫酸常用接触法,工业上制硝酸是用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A.在沸腾炉中进行的反应为:4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
B.氨被氧气催化氧化:4NH3+5O2 4NO+6H2O
4NO+6H2O
C.硫酸工业、硝酸工业都需要对工业尾气进行处理
D.接触法制硫酸的原料为:二氧化硫、空气、水
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图是课外活动小组的同学设计的4个喷泉实验方案。下列有关操作不可能引发喷泉现象的是( )

A.挤压装置①的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹
C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹
D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹
查看答案和解析>>
科目:高中化学 来源: 题型:
为确定某溶液的离子组成,进行如下实验:①测定溶液的pH,溶液显强碱性;②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;③在②中溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;④取③中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验现象,以下推测正确的是( )
A.一定有SO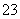
B.一定有CO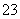
C.一定有Cl-
D.不能确定HCO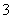 是否存在
是否存在
查看答案和解析>>
科目:高中化学 来源: 题型:
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:
FeSO4+Na2CO3===FeCO3↓+Na2SO4
FeCO3+C6H8O7===FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
(1)制备FeCO3时,选用的加料方式是________(填字母,)原因是________________________________________________________________________。
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是________________________________________________________________________________________________________________________________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80 ℃下搅拌反应。
①铁粉的作用是______________________________________________ _____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________________________________________________________________________________________________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是________________________________________________________________________。
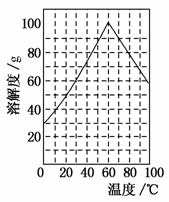
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。请结合上图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,__________________________________________________________________________________________________________________________________,得到FeSO4溶液,_________________________________ _____________________________________________,得到FeSO4·7H2O晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com