
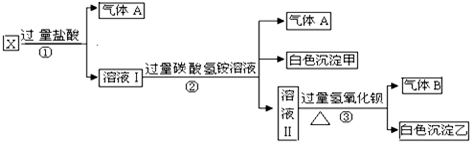


科目:高中化学 来源: 题型:
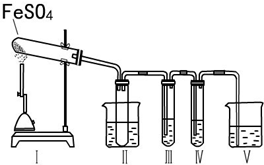 硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.
硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等.| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 | 固体中含有Fe2O3 | |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液. | 产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
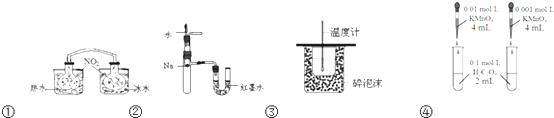
| A、装置①依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤②①③⑥ |
| B、①②③⑤⑦ |
| C、⑤②①④⑧ |
| D、①②⑤③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
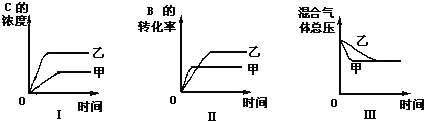
| A、图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
| B、图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
| C、图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
| D、图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com