
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和二甲胺[(CH3)2NH]溶液,利用传感器测得滴定过程中溶液的电导率如图所示(已知常温下二甲胺的电离常数Kb=1.6×10-4)。下列说法正确的是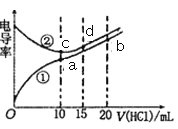
A. 曲线①代表滴定二甲胺溶液的曲线,pH=7时所消耗的V[HCl(aq)]大于10 mL
B. 在a、b、c 三点溶液中,水电离出的c(H+):a<c<b
C. 曲线中c点电导率最小,原因是c点溶液中导电微粒的数目最少
D. d 点溶液呈酸性,且有3c(H+)=c(Cl-)+3c(OH-)
【答案】D
【解析】A. 曲线①代表滴定二甲胺溶液的曲线,二甲胺与盐酸反应生成的是强酸弱碱盐,根据题意要使pH=7,所消耗的V[HCl(aq)]小于10 mL,故A错;B. 在a点二甲胺与盐酸恰好反应,生成强酸弱碱盐,会发生水解,促进水的电离;在b点为酸过量,抑制水的电离;c点时NaOH和盐酸恰好完全反应,生成NaCl为强酸强碱盐,不水解,溶液显中性,所以a、b、c 三点溶液中,水电离出的c(H+):b<c<a,故B错误;C. 曲线中c点NaOH和盐酸恰好完全反应,生成NaCl属于强电解质,完全电离,导电率大于a点,故C错误; D. 因为HCl+NaOH=NaCl+H2O,0.100 mol·L-1盐酸15mL与10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液混合,酸过量,所以溶液显酸性,溶液中存在下列电离H2O![]() H++OH- NaCl=Na++ Cl- HCl= H++ Cl- 根据物料守和电荷守恒可得3c(H+)=c(Cl-)+3c(OH-),故D正确。
H++OH- NaCl=Na++ Cl- HCl= H++ Cl- 根据物料守和电荷守恒可得3c(H+)=c(Cl-)+3c(OH-),故D正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】铂(Pt)可以和很多化合物形成配合物,生产生活中有重要的用途。
(1)铂和氨水可以形成配合物。可用于提取铂。氨水中各元素的第一电离能由大到小的顺序___。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体,科学研究表明,反式分子和顺式分子一样具有抗癌活性。
①C1-的核外电子排布式为_______。
②吡啶分子是大体积平面配体,其结构简式为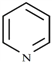 ,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号
,吡啶分子中氮原子的轨道杂化方式是_____,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π鍵的电子数,则吡啶中的大π键应表示为_____;1mol吡啶中含有σ键的数目为________
③二氯二吡啶合铂分子中存在的微粒间作用力有_____(填字母)。
a.离子健 b.配位键c.金属键 d.非极性键e.氢键f.极性键
④二氯二吡啶合铂分子中,Pt2+的配位数是4,但是其轨道杂化方式并不是sp3。简述理由_____________。
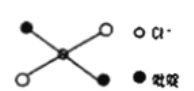
⑤反式二氯二吡啶合铂分子结构如图所示,该分子是_____分子(其“极性”或“非极性”)。
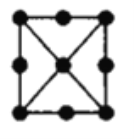
(3)富勒烯C60能够与Pt结合形成一系列络合物。富勒烯(C60)的结构如图所示,C60属于____晶体;C60分子中五元环与六元环的数目比为__________。
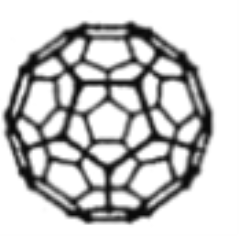
(已知简单多面体的顶点数V、棱数E及面数F间有如下关系:V-E+F=2)。
(4)金属铂立方晶胞的二维投影图如图所示。若金属铂的密度dg/cm3,则晶胞参数a=___nm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容.某兴趣小组做如下探究实验:

(1)如图1为某实验小组依据氧化还原反应设计的原电池装置,该反应的离子方程式为__________________,反应前两电极质量相等,一段时间后,两电极质量相差15g,导线中通过__mol电子.
(2)如图1,其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极的电极反应式为___________________________________,这是由于NH4Cl溶液显____性,用离子方程式表示溶液显此性的原因__________________________________________
(3)如图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成∩型,则乙装置中石墨电极(1)为__极,甲装置中铜电极上电极反应式为_____

(4)如图2乙装置中改为加入400mL CuSO4溶液,一段时间后,若电极质量增重1.28g,则此时溶液的pH为__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的杂质-碳纳米颗粒,可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 + 8H2SO4= 3CO2 + 2K2SO4+ 2Cr2(SO4)3 + 8H2O
①请用双线桥法标出电子转移方向和数目__________________________________
②上述反应中氧化剂是___________________(填化学式)。
(2)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为_________________________________________
②结合Ⅰ、Ⅱ实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学过程对应的方程式表示正确的是 ( )
A. 碳酸氢钠溶液的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. 醋酸的电离:CH3COOH=CH3COO-+H+
C. 碳酸钙的溶解平衡CaCO3(s) ![]() Ca2+(aq)+CO32-(aq)
Ca2+(aq)+CO32-(aq)
D. 硫化钠溶液呈碱性的原因:S2-+H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由短周期元素组成的一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)

请回答下列问题:
(1)物质A的化学式为________;
(2)化合物I的化学式为________;
(3)反应①的化学方程式为_____________;反应②的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H10O3的有机物,一定条件下具有如下性质:
①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应②在浓硫酸存在下,能脱水生成两种结构不同的能使溴水褪色的物质③在浓硫酸存在下,能生成一种分子式为C5H8O2的五元环状化合物,则C5H10O3的结构简式为( )
(已知:![]() )
)
A. HOCH2COOCH2CH2CH3 B. CH3CH(OH)CH2CH2COOH
C. CH3CH(OH)CH(CH3)COOH D. HOCH2CH2CHCH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对某葡萄酒中SO2的含量进行检测,按下图连接好仪器。回答下列问题:

Ⅰ.样品蒸馏
取20.00mL样品和250 mL水置于仪器A中,仪器B是去掉塞子的碘量瓶,向其中装人25mL 乙酸铅溶液,然后向仪器A中加入10 mL盐酸,立即盖塞蒸馏;当碘量瓶中的液体约200 mL时,将插入碘量瓶液面下的导管向上提起并将导管置于液面上方1cm 处,再蒸馏2min左右;最后用少量蒸馏水冲洗碘量瓶中的导管,并将冲洗液并入碘量瓶中。同时做空白实验(即不加样品情况下按同法操作,防止实验误差)。
已知:SO2+H2O+Pb(CH3COO)2=PbSO3↓+2CH3COOH。
(1)仪器A 的名称是_________________ 。
(2)实验中使用的碘量瓶最适宜的规格是_________ (填标号)。
a.100 mL b.250 mL c.500 mL d.1000 mL
(3)如果实验最后未用少量蒸馏水冲洗碘量瓶中的导管,会导致测定结果__________(填“偏高”“ 偏低”或“不影响”)。
Ⅱ.滴定操作
向取下的碘量瓶中加入10 mL盐酸和1mL淀粉溶液,摇匀后用0.01mol·L-1的碘标准溶液滴定,记录消耗的碘标准溶液的体积为V( 单位为mL)。
(4)滴定终点的现象是_____________________,该滴定反应的离子方程式是______________。
Ⅲ.结果分析
(5)甲组4 次实验测得V分别为
实验 | 1 | 2 | 3 | 4 |
V/mL | 9.98 | 12.00 | 10.02 | 10.00 |
据此可计算此葡萄酒中SO2的含量为_______mg·L-1
乙组认为甲组实验不严谨,可能会有误差,因为甲组未做_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置进行实验,下列现象能推断出结论的是( )
选项 | 试剂X | Y中试剂及现象 | 结论 | 装置 |
A | 一种盐 | 酚酞溶液未变红 | 该盐不可能是铵盐 |
|
B | 小苏打和纯碱 | 石灰水变浑浊 | 纯碱比小苏打稳定 | |
C | 氢氧化钙与氯化铵 | 硝酸银溶液中先产生沉淀后溶解 | Ag2O能溶于氨水 | |
D | 氯酸钾与二氧化锰 | 淀粉、碘化钾和和硫酸的混合溶液变蓝 | 反应产生了Cl2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com