
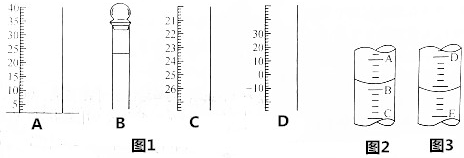
分析 (1)根据常见计量仪器的结构特征分析;
(2)量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为4,则刻度B为3,AB间每一小格为0.2mL,则量筒中液体的体积为3.2mL.
滴定管大刻度在下方,D与E之间的刻度差为1mL,如果刻度D为4,则E刻度为5,DE间每一小格为0.10mL,则该酸式滴定管中液体体积的读数为4.60mL.
解答 解:(1)A无0刻度,从下到上刻度逐渐增大,应为量筒,B有活塞,且只有一个刻度线,应为容量瓶,C刻度从上到下逐渐增大,为滴定管,D刻度有负值,应为温度计,故答案为:量筒;容量瓶;滴定管;温度计;
(2)量筒小刻度在下,A与B与C刻度间相差1mL,刻度A为4,则刻度B为3,AB间每一小格为0.2mL,则量筒中液体的体积为3.2mL.
滴定管大刻度在下方,D与E之间的刻度差为1mL,如果刻度D为4,则E刻度为5,DE间每一小格为0.10mL,则该酸式滴定管中液体体积的读数为4.60mL.
故答案为:3.2;4.60.
点评 本题考查常见计量仪器的使用,题目难度不大,注意常见计量仪器的结构特征和使用方法.


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:解答题
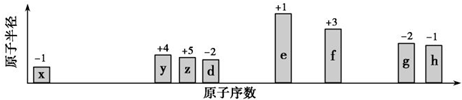
 原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.
原子序数小于36的X、Y、Z、W、R五种元素,原子序数依次增大.五种元素中,仅R为金属元素,其原子序数为27.X价电子排布式为nsnnpn,元素Z基态原子s电子总数与p电子总数相等,W与其它四种元素能层数不同,且未成对电子数目为1个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
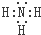 ;
;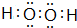 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先加入酸性高锰酸钾溶液;加稀硝酸酸化后加银氨溶液,微热 | |
| B. | 先加入溴水;加稀硝酸酸化后加酸性高锰酸钾溶液 | |
| C. | 先加入新制氢氧化铜悬浊液,加热;加稀硝酸酸化,再加入溴水 | |
| D. | 先加入银氨溶液;再另取该物质加入溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
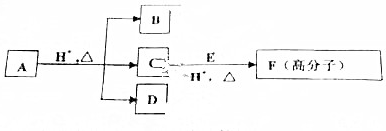
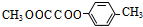 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
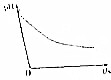 某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )
某离子反应涉及H2O、CLO-、NH4+、H+、N2、CL-六种微粒.常温条件下反应时,溶液pH随时间变化的曲线如图所示,下列判断错误的是( )| A. | 该反应的氧化剂是CLO- | |
| B. | 该反应中有两种离子生成 | |
| C. | 该反应生成1mol氧化产物时,转移的电子为6mol | |
| D. | 参加反应的氧化剂与还原剂的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
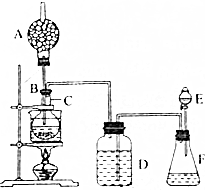
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素W与氢形成原子比为1:1的化合物有多种 | |
| B. | 元素X的单质能与水、无水乙醇反应 | |
| C. | 离子Y3+与Z-的最外层电子数和电子层数都不相同 | |
| D. | 元素W与元素Z可形成含有极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
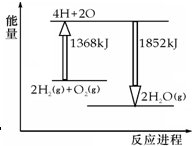
| A. | 拆开2molH2(g)和1molO2(g)中的化学键成为H、O原子,共吸收1368kJ能量 | |
| B. | 由H、O原子形成2molH2O(g),共放出1852kJ能量 | |
| C. | 2molH2(g)和1molO2(g)反应生成2molH2O(g),共吸收484kJ能量 | |
| D. | 2molH2(g)和1molO2(g)反应生成2molH2O(l),放出热量大于484kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com