
| A. | 热稳定性NaHCO3<Na2CO3 | B. | 常温时水中溶解度NaHCO3>Na2CO3: | ||
| C. | 与盐酸反应的速率:NaHCO3>Na2CO3 | D. | 相对分子质量:NaHCO3<Na2CO3 |
分析 A.碳酸氢钠加热分解生成碳酸钠、二氧化碳与水.
B.难溶性碳酸盐溶解度小于相应的碳酸氢盐,可溶性碳酸盐的溶解度大于相应的碳酸氢盐.
C.碳酸钠与盐酸反应先转化为碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳.
D.碳酸氢钠相对分子质量为84,碳酸钠相对分子质量为106.
解答 解:A.碳酸氢钠加热发生分解反应2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,而碳酸钠加热不分解,故A正确;
B.常温下水中,Na2CO3较NaHCO3易溶,故B错误;
C.碳酸钠与盐酸反应先转化为碳酸氢钠,碳酸氢钠再与盐酸反应生成二氧化碳,故相同条件下,与酸反应的速率碳酸钠<碳酸氢钠,故C正确;
D.碳酸氢钠相对分子质量为84,碳酸钠相对分子质量为106,相对分子质量:NaHCO3<Na2CO3 ,故D正确.
故选B.
点评 本题考查Na2CO3和NaHCO3性质的异同,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:选择题
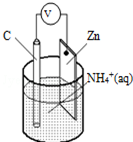
| A. | 碳为电池的负极 | B. | Zn极上发生氧化反应 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
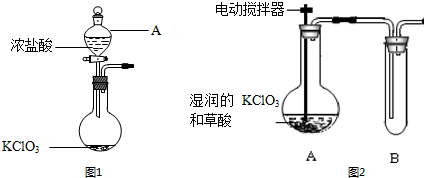

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
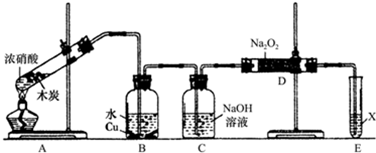
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com