
【题目】下列事实不能用来判断非金属性强弱依据的是
A. 单质的熔点、沸点高低
B. 非金属之间发生的置换反应
C. 非金属与氢气生成气态氢化物的难易程度
D. 非金属元素的最高价氧化物的水化物的酸性强弱
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是
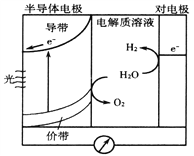
A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列化合物:①CH3COOH ②Na2C2O4③NaCl ④NaOH⑤NH4Cl.回答问题:
(1)H2C2O4是弱酸,则②溶液中盐水解的离子方程式为;
(2)浓度均为 0.1molL﹣1 的④、⑤溶液等体积混合后,c(Na+)+c(NH4+)+c(NH3H2O)=;
(3)常温下,pH都为4的①、⑤溶液中水电离出的c(OH﹣)的比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应可以为人类提供能源,也可用来解决环境问题。
(1)已知某些化学键的键能数据如下:
化学键 | H-H | O=O | O-H |
键能kJ·mol-1 | 436 | 495 | 463 |
①写出H2与O2反应生成水蒸气的热化学方程式____________;
②利用该反应设计成燃料电池,已知该电池每发1kW·h电能生成360g水蒸气,则该电池的能量转化率为_____%(结果保留三位有效数字)。
(2)三室式电渗析法可以处理含K2SO4的废水,原理如图所示,两极均为惰性电极,ab为阳离子交换膜,cd为阴离子交换膜。
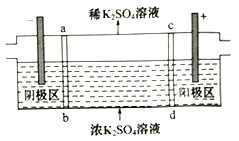
①阴极区的pH______(填“升高”或“降低”);
②阳极发生的电极反应式为__________;
③当电路中通过1mol电子的电量时,阴极上生成气体的体积为_____L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是种重要的工业原料,可用于制备补血剂乳酸亚铁。某研究小组 通过下列实验,寻找利用复分解反应制各FeCO3的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNa2CO3溶液(pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,后出现明显的红褐色 |
0.8mol/LFeSO4溶液(pH=4.5) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅱ: 产生白色沉淀及少量无色气泡,2min,后出现明显的灰绿色 | |
0.8mol/L(NH4)2Fe(SO4)2溶液(pH=4.0) | 1mol/LNaHCO3溶液(pH=8.6) | 实验Ⅲ: 产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验I中产生HCO3-和红褐色沉淀的离子方程式为___________
(2)实验Ⅱ中产生FeCO3的离子方程式为___________
(3)为了探究实验Ⅲ中NH4+所起的作用,甲同学设计了实验Ⅳ进行探究:
操作 | 现象 | |
实验Ⅳ | 向0.8mol/LFeSO4溶液中加入_____,再加入一定量Na2SO4固体配制成混合溶液(已知Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与2mL1mol/LNaHCO3溶液混合 | 与实验Ⅲ现象相同 |
实验Ⅳ中加入Na2SO4固体的目的是_____
对比实验Ⅱ、Ⅲ、Ⅳ,甲同学得出结论:NH4+水解产生H+,降低溶液pH,减少了副产物Fe(OH)2的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是_____.再取该溶液一滴管2mL 1mol/L NaHCO3溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验Ⅲ中FeCO3的纯度最高。需要利用如图所示的装置进行定量测定。
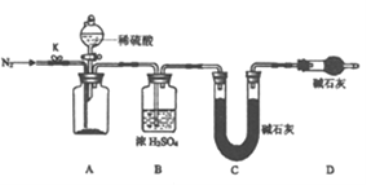
分别将实验Ⅰ、Ⅱ、Ⅲ中的沉淀进行过滤、洗涤、干燥后称量,然后转移至A处的广口瓶中。反应完成后通入N2的作用是_______。为测定FeCO3的纯度,除样品总质量外,还需测定的物理量是_________
(5)实验反思:经测定,实验Ⅲ中的FeCO3纯度高于实验Ⅰ和实验Ⅱ。通过以上实验分析。制备FeCO3实验成功的关键因素是__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是;
(2)氧的原子结构示意图是;
(3)形成化合物种类最多的元素是;
(4)HF和H2O中,热稳定性较强的是;
(5)N和P中,原子半径较小的是;
(6)常温下,会在浓硫酸中发生钝化的金属是;
(7)元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“HClO4”);
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 , 其中硫元素和氧元素的质量比m(S):m(O)= . (相对原子质量:S﹣32,O﹣16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)碳有三种同素异形体:金刚石、石墨、足球烯(C60),其中足球烯是分子晶体。据此推测下列叙述正确的是( )
A. 金刚石、石墨、足球烯和氧气反应最终产物不同
B. 足球烯可以发生加成反应
C. 石墨、足球烯均作为生产耐高温润滑剂的原料
D. 足球烯在苯中的溶解度比在乙醇中的溶解度大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com