
ĪĀ¶ČĪŖTŹ±£¬Ļņ 2.0 LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė1.0 mol PCl5£¬·“Ó¦PCl5(g) 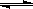 PCl3(g)+Cl2(g)¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
PCl3(g)+Cl2(g)¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
t / s | 0 | 50 | 150 | 250 | 350 |
n | 0 | 0£®16 | 0£®19 | 0£®20 | 0£®20 |
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®·“Ó¦ŌŚĒ°50sµÄĘ½¾łĖŁĀŹv(PCl3)=0£®0032mol”¤L-1”¤s-1
B£®±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±c(PCl3)=0£®11mol”¤L-1£¬Ōņ·“Ó¦µÄ”÷H<0
C£®ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė1£®0molPCl5”¢0£®20molPCl3ŗĶ0£®20molCl2£¬·“Ó¦“ļµ½Ę½ŗāĒ°v(Õż)£¾v(Äę)
D£®ĻąĶ¬ĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2£®0molPCl3ŗĶ2£®0molCl2£¬“ļµ½Ę½ŗāŹ±£¬PCl3µÄ×Ŗ»ÆĀŹŠ”ÓŚ80%

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘĻĢŃĢĒÄÜ·¢ÉśĖ®½ā·“Ӧɜ³ÉŅŅ“¼ŗĶ¶žŃõ»ÆĢ¼ | |
| B£® | °±»łŅŅĖį”¢ĀČŅŅĻ©”¢ŅŅ¶ž“¼¾łæÉ·¢Éś¾ŪŗĻ·“Ó¦ | |
| C£® | ŹµŃéŹŅÓĆäåŅŅĶéŌŚÅØĮņĖį”¢170”ęĢõ¼žĻĀÖʱøŅŅĻ© | |
| D£® | ±½·ÓÄÜøśĢ¼ĖįÄĘČÜŅŗ·“Ó¦£¬±½·ÓµÄĖįŠŌ±ČĢ¼ĖįĒæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½¶«Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
ŅŃÖŖ8gAÄÜÓė32gBĒ”ŗĆ·“Ó¦£¬Éś³É22gCŗĶŅ»¶ØĮæD£¬ĻÖ½«16gAÓė70gBµÄ»ģŗĻĪļ³ä·Ö·“Ó¦ŗó£¬Éś³É2molDŗĶŅ»¶ØĮæC£¬ŌņDµÄĦ¶ūÖŹĮæĪŖ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½¶«Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ŌŚpH=1ČÜŅŗÖŠÄÜ“óĮæ¹²“ęµÄŹĒ
A£®Na+”¢SO42-”¢Ba2+”¢Cl- B£®Na+”¢K+”¢CH3CHOO-”¢NO3-
C£®H+”¢Cu2+”¢OH-”¢CO3- D£®Na+”¢K+”¢Cl-”¢NO3-
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½¶«Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÉčNA±ķŹ¾°¢·üŁ¤µĀĀŽ³£ŹżµÄÖµ£¬ĻĀĮŠĖµ·ØÖŠÕżČ·µÄŹĒ
A£®1molNH4+Ėłŗ¬ÖŹ×ÓŹżĪŖ10 NA
B£®6.8gŅŗĢ¬KHSO4ÖŠŗ¬ÓŠ0.1NAøöŃōĄė×Ó
C£®³£ĪĀ³£Ń¹ĻĀ£¬22.4 LSO2Ėłŗ¬µÄ·Ö×ÓŹżĪŖNA
D£®³£ĪĀ³£Ń¹ĻĀ£¬32 gO2ŗĶO3µÄ»ģŗĻĘųĢåĖłŗ¬Ō×ÓŹżĪŖ 2NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻµŚŅ»“ĪŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³£ĪĀĻĀ£¬ĻĀĮŠø÷×é±ČÖµĪŖ1”Ć2µÄŹĒ
A£®0.1 mol/LÓė0.2 mol/L“×ĖįČÜŅŗ£¬c(H+)Ö®±Č
B£®0.1 mol/L Na2CO3ČÜŅŗ£¬c(CO32£)Óėc(Na+) Ö®±Č
Ö®±Č
C£®pH=10µÄBa(OH)2ČÜŅŗÓė°±Ė®£¬ČÜÖŹµÄĪļÖŹµÄĮæÅضČÖ®±Č
D£®pH=3µÄĮņĖįÓė“×ĖįČÜŅŗ£¬c(SO42£)Óėc(CH3COO£)Ö®±Č
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017ѧğ½Ī÷Ź”ø߶žÉĻµŚŅ»“ĪŌĀæ¼»Æѧ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠÓŠ¹Ųµē½āÖŹČÜŅŗµÄŠšŹö£¬²»ÕżČ·µÄŹĒ
A£®Ļ”“×Ėį¼ÓĖ®Ļ”ŹĶ£¬“×ĖįµēĄė³Ģ¶ČŌö“ó£¬ČÜŅŗµÄpHÉżøß
B£®ŌŚCH3COONaČÜŅŗÖŠ¼ÓČėŹŹĮæCH3COOH£¬æÉŹ¹c£ØNa+£©=c£ØCH3 COO ££©
C£®ŌŚĀČĖ®ÖŠĶØČėĀČ»ÆĒāĘųĢåŗó£¬ČÜŅŗÖŠc£ØHClO£©¼õŠ”
D£®³£ĪĀĻĀ£¬pH =2µÄŃĪĖįÓėpH =12µÄ°±Ė®µČĢå»ż»ģŗĻĖłµĆČÜŅŗÖŠ£ŗ
c£ØCl££©>c£ØNH4+£©>c£ØH+£©>c£ØOH££©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com