
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( ) 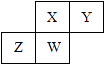
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
【答案】A
【解析】解:A、同一周期的元素,原子序数越大,原子半径越小,不同周期的元素,原子核外电子层数越多,原子半径就越大,所以原子半径大小关系是:Z>W>X>Y,故A错误; B、元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,元素的非金属性:X>W>Z,所以它们的最高价氧化物对应水化物的酸性:X>W>Z,故B正确;
C、元素的非金属性越强,其相应的氢化物的稳定性就越强,元素的非金属性:Y>X>W>Z,所以元素的氢化物的稳定性:Y>X>W>Z,故C正确;
D、主族元素除了O和F之外,最高化合价等于主族序数,所以X、Z、W的最高化合价分别与其主族序数相等,故D正确;
故选A.
短周期元素w的质子数是其最外层电子数的三倍,则W是P元素,根据元素在周期表中的位置关系可确定:X是N元素,Y是O元素,Z是Si元素,由此分析解答.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:
【题目】下列各组顺序的排列不正确的是( )
A. 原子半径:Na>Mg>AlB. 热稳定性:HCl> H2S>PH3
C. 还原性:I–<Br–<Cl–D. 熔点:金刚石>食盐>干冰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( ) 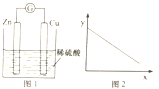
A.铜棒的质量
B.c(Zn2+)
C.c(H+)
D.c(SO42﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同元素的原子电负性不同,若用x值来表示,x值越大,其原子的电负性就越大,吸引电子的能力越强,在所形成的分子中成为带负电荷的一方,下面是某些短周期元素的电负性的值:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
第二周期 | Li | Be | B | C | N | O | F |
电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | |
第三周期 | Na | Mg | Al | Si | P | S | Cl |
电负性值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值的变化规律,确定N、Mg的x值的范围:<x(Mg)< , <x(N)< .
(2)推测x值与原子半径的关系是 . 根据短周期元素x值变化特点,体现了元素性质的变化规律.
(3)某有机物结构简式如图,其中C﹣N中,你认为共用电子对偏向原子(填原子名称). 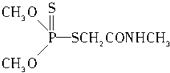
(4)经验规律告诉我们,当成键的两原子的x差值,即△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键.试推断AlBr3中化学键的类型为
(5)预测元素周期表中x值最小的元素是(填元素符号,放射性元素除外).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的量变化如图所示,对该反应的推断合理的是( ) 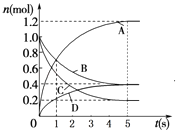
A.该反应的化学方程式为6A+2 D3B+4C
B.反应进行到1 s时,v(A)=v(B)
C.反应进行到5 s时,B的平均反应速率为0.06mol/(Ls)
D.反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入过量的稀硫酸,同时向a中加入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
A.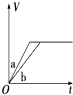
B.
C.
D.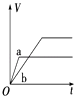
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.40mol NO2气体充入2L的密闭容器中,发生如下反应:2NO2(g)N2O4(g)△H<0.监测反应获得如表数据:下列说法正确的是( )
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
A.0~20 s内,v(NO2)=0.005 mol?L﹣1?s﹣1
B.59 s时,c(NO2)一定大于0.12 mol?L﹣1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K> ![]()
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨反应:N2+3H22NH3是一个放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂.已知形成1mol H﹣H键、1mol N﹣H键、1mol N≡N键放出能量分别为436kJ、391kJ、946kJ.则:
(1)若1mol N2完全反应生成NH3可(填“吸收”或“放出”)热量kJ.
(2)如果将1mol N2和3mol H2混合,使其充分反应,放出的热量总小于上述数值,其原因是
(3)实验室模拟工业合成氨时,在容积为2L的密闭容器内,反应经过10min后,生成10mol NH3 , 则用N2表示的化学反应速率为 .
(4)一定条件下,当合成氨的反应达到化学平衡时,下列说法正确的是 . a.正反应速率和逆反应速率相等
b.正反应速率最大,逆反应速率为0
c.N2的转化率达到最大值
d.N2和H2的浓度相等
e.N2、H2和NH3的体积分数相等
f.反应达到最大限度
(5)在四个不同容器中,不同条件下进行合成氨反应.根据在相同时间内测定的结果,判断该反应的速率由大到小的顺序是(用编号填写).
A.V(NH3)=0.5molL﹣1﹣min﹣1
B.V(H2)=0.3molL﹣1﹣min﹣1
C.V(N2)=0.2molL﹣1﹣min﹣1
D.V(H2)=0.01molL﹣1﹣s﹣1 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com