
I.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,HA- H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度________(填“>”、“<”或“=”)0.11mol·L-1。
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是 ,
②写出亚磷酸与少量NaOH溶液反应的离子方程式 。
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g) CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
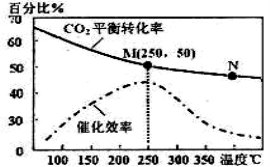
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是_______(填序号)
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g) 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(3)若在500℃时,投料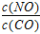 =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源:2016-2017学年浙江省高一上期中化学试卷(解析版) 题型:选择题
下列关于Fe(OH)3胶体的说法中,不正确的是
A.分散质粒子直径在l0-9~10-7m之间 B.是一种纯净物
C.具有丁达尔效应 D.具有净水作用
查看答案和解析>>
科目:高中化学 来源:2017届安徽师大附中高三上新课标模拟化学卷(解析版) 题型:选择题
下列有关说法正确的是
A.塑料、合成纤维和合成橡胶都属干合成材料
B.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
C.(CH3)3CCH2CH3的一氯代物有5种
D.合成顺丁橡胶(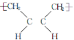 )的单体是CH3-CH=CH-CH3
)的单体是CH3-CH=CH-CH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
通过以下反应均可获取H2。下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+O2(g) ΔH1=571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+H2O(g)=CO(g)+H2(g) ΔH2=131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH3=206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=74.8kJ·mol–1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁东北育才学校高二上阶段考二化学卷(解析版) 题型:选择题
某电动汽车配载一种可充放电的锂离子电池。放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+C6(x<1)。下列关于该电池的说法不正确的是
A.放电时 ,Li+在电解质中由负极向正极迁移
,Li+在电解质中由负极向正极迁移
B.放电时,负极的电极反应式为LixC6-xe-=xLi++ C6
C.充电时,若转移1 mol e-,石墨C6电极将增重7x g
D.充电时,阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考三化学试卷(解析版) 题型:选择题
在体积都为1L,pH=2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是( )
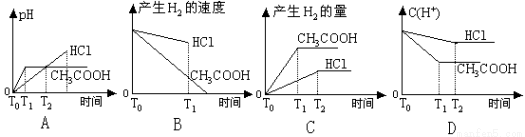
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上月考三化学试卷(解析版) 题型:选择题
实验室用标准 KMnO4 溶液滴定未知浓度的 FeSO4,下列说法或操作正确的是( )
A.盛 FeSO4溶液的锥形瓶滴定前用 FeSO4溶液润洗 2—3 次
B.选碱式滴定管盛放标 准 KMnO4溶液,并用碘化钾淀粉溶液作指示剂
准 KMnO4溶液,并用碘化钾淀粉溶液作指示剂
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.滴定前仰视读数,滴定后俯视读数会导致滴定 结果偏低
结果偏低
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上月考二化学试卷(解析版) 题型:选择题
乙醇燃料电池中采用磺酸类质子溶剂,在200 ℃左右时供电,电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图。下列说法中,错误的是
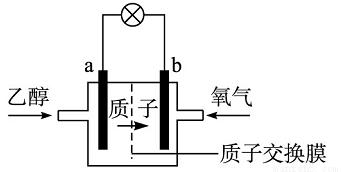
A.电池工作时,质子向电池的正极迁移
B.电池工作时,电流由b极沿导线流向a极
C.a极上发生的电极反应是C2H5OH+3H2O-8e-=2CO2+12H+
D.b极上发生的电极反应是4H++O2+4e-=2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年海南省高二上期中理化学试卷(解析版) 题型:填空题
氨在工农业生产中应用广泛。
(1)根 据下图写出合成氨的热化学方程式是________________________。
据下图写出合成氨的热化学方程式是________________________。
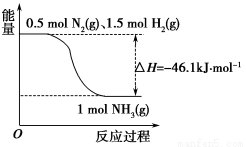
(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量___________(填“大于”、“等于”或“小于”)92.2 kJ,原因是______________;若加入催化剂,ΔH________(填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N≡N键、1 mol H-H键时需要吸收的能量为946 kJ、4 36 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
36 kJ,则破坏1 mol N—H键需要吸收的能量为________kJ。
(4)N2H4可视为NH3分子中的H被-NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)==2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+ O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
O2(g)==N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com