
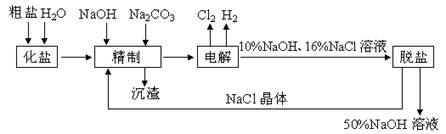
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下: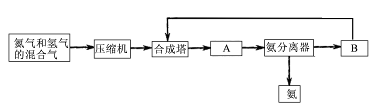
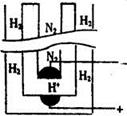
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.联合制碱法的优点是减少了对设备的腐蚀 |
| B.工业生产硫酸时,用98%硫酸的来吸收三氧化硫,可以避免形成酸雾并提高吸收率 |
| C.合成氨是天然固氮的方法之一 |
| D.碳酸钠俗称小苏打,甲烷是一种清洁能源 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
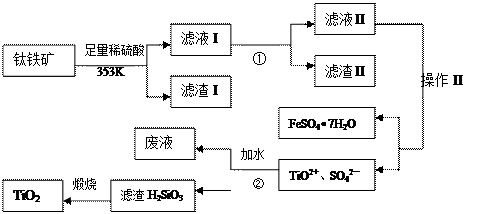
| A.Fe | B.Ca(OH)2 | C.NH3?H2O | D.NaOH |
 生的反应为:
生的反应为: 92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。
92),则产品中硫酸亚铁铵晶体纯度的计算式可表达为:w%= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述生产过程中的尾气可以通入氨水中,生产氮肥 |
| B.电解精炼时,粗铜应与外电源的正极相连 |
| C.反应2Cu2O+Cu2S→6Cu+SO2↑中的Cu2O是氧化剂 |
| D.每生产6mol Cu,理论上需消耗11mol O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
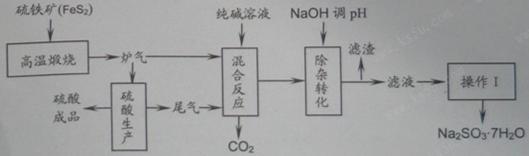
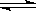 2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
2SO3(g)。研究发现,SO3的体积分数(SO3%)随温度(T)的变化如曲线Ⅰ所示。下列判断正确的是________
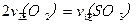
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体硅是良好的半导体材料,是信息技术的关键材料 |
| B.开发利用风能、太阳能、生物质能等新能源符合“低碳经济”战略 |
| C.海轮外壳上镶入锌块,可减缓船体的腐蚀 |
| D.酸雨就是pH <7的雨水,主要是由大气中的SO2、NO2等造成的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
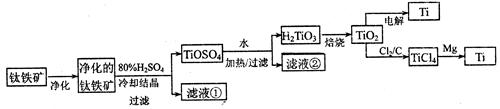
 TICl4(l) +O2(g)顺利进行的原因是:
TICl4(l) +O2(g)顺利进行的原因是: 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com