
���� ��1��������ȡ�����ķ�Ӧԭ��������
��2������������ԭ��Ӧ����ȡ�����Ļ�ѧ����ʽ������
��� �⣺��1��Ũ�����к���HCl��0.2L��10mol/L�T2mol
���ݻ�ѧ����ʽ����֪�ڶ������̹����������£����HCl��ȫ��Ӧ������������0.5mol������Ũ������������̷�Ӧ��Ϊϡ������ᷴӦ���������������ɵ�������С��0.5mol���ʴ�Ϊ��С�ڣ����ŷ�Ӧ�Ľ��У������Ũ����С��ϡ������������̲��ٷ�Ӧ����ӦС��0.5mol��
��2��n��MnO2��?$\frac{870g}{87g/mol}$�T10mol����MnO2+4HCl?MnCl2+Cl2��+2H2O�У�ÿ��10mol�������̷�Ӧ���ͻ���40molHCl��Ӧ������Ԫ�ػ��ϼ۷����仯����������HClֻ��20mol���ݴ˿�֪��870gMnO2��ȫ��Ӧ���������Ȼ�������ʵ�����20mol��
�𣺱��������Ȼ�������ʵ�����20mol��
���� ���⿼����ʵ������ȡ�����ķ�Ӧԭ�����ݻ�ѧ����ʽ�ļ��㣬�Լ�����ȡ�����йص�������ԭ��Ӧ֪ʶ����Ϊ�ۺϣ�Ҳ��Ϊ�������ܺܺõؿ���֪ʶ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2 | B�� | CH2O2 | C�� | C6H12O6 | D�� | C12H22O11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
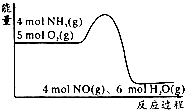 ��һ���������ܱ������з���4NH3��g��+5O2��g��?4NO��g��+6H2O��g������H=akJ/mol����Ӧ�����������仯��ͼ��ʾ������˵����ȷ���ǣ�������
��һ���������ܱ������з���4NH3��g��+5O2��g��?4NO��g��+6H2O��g������H=akJ/mol����Ӧ�����������仯��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ��ͼ��֪a��0 | |
| B�� | �����¶ȿ������NH3��ת���� | |
| C�� | ��Ӧ��ϵ�м�����������ӷ�Ӧ�� | |
| D�� | ��ƽ������ͨ��ˮ��һ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������������ͨ��dz��ɫ����ˮ��ʹ����ɫ��ȥ��˵�������������Ư���� | |
| B�� | Na��Mg��Fe�Ƚ�����һ����������ˮ��Ӧ������H2�Ͷ�Ӧ�ļ� | |
| C�� | ��ɰֽ��ĥ�����������ھƾ������ϲ�ȼ�գ�˵����������O2��Ӧ | |
| D�� | ��װ��NaHCO3��Һ����֧�Թ��и�����CaCl2��MgCl2�ı�����Һ�������г������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڶ�����Ԫ���⻯���ȶ���˳����HF��H2O��NH3�����������Ԫ���⻯���ȶ���˳��Ҳ��HCl��H2S��PH3 | |
| B�� | SiO2�����ۻ�ʱ�ƻ����ǹ��ۼ�������CO2�����ۻ�ʱ�ƻ���Ҳ�ǹ��ۼ� | |
| C�� | �ɵ������MgCl2����ȡ����þ��Ҳ�ܵ������AlCl3����ȡ������ | |
| D�� | �������������ӣ����������ӣ��������������ӣ�Ҳ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��̼�����缫��ⱥ��MgCl2��Һ 2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$Cl2��+H2��+2OH- | |
| B�� | FeO��������ϡHNO3�У�FeO+2H+�TFe2++H2O | |
| C�� | ������Һ��ͨ������CO2���壺 +CO2+H2O�� +CO2+H2O�� ��+CO32- ��+CO32- | |
| D�� | ��AlCl3��Һ�м��������ˮAl3++3NH3•H2O�TAl��OH��3��+3NH4+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 80% | B�� | 75% | C�� | 60% | D�� | 40% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com