
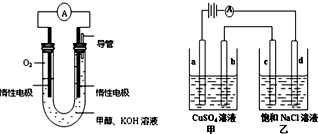
分析 (1)“原子经济性”是指在化学品合成过程中,合成方法和工艺应被设计成能把反应过程中所用的所有原材料尽可能多的转化到最终产物中;
(2)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(g)═H2O(l)△H3
依据盖斯定律计算(①-②+4×③)×$\frac{1}{2}$得到热化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$+2△H3,由此分析解答;
(3)①在燃料电池中,负极是燃料发生失电子的氧化反应,即CH3OH+8OH--6e-=CO32-+6H2O;
②CH3OH+8OH--6e-=CO32-+6H2O,氢氧根离子被消耗;
③c电极上氯离子放电生成氯气;根据转移电子相等计算消耗氧气体积;根据“析出什么加入什么”的原则确定加入物质.
解答 解:(1)根据原子经济知,Ⅰ没有副产物,符合原子经济理念,Ⅱ中有副产物,不符合原子经济理念,故答案为:I;
(2)①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1
②2CO(g)+O2(g)═2CO2(g)△H2
③H2O(g)═H2O(l)△H3
依据盖斯定律计算(①-②+4×③)×$\frac{1}{2}$得到热化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$+2△H3=$\frac{-1275.6kJ/mol-(-566.0kJ/mol)}{2}$=-442.8kJ∕mol,故答案为:-442.8kJ∕mol;
(3)①在燃料电池中,负极是燃料发生失电子的氧化反应,即CH3OH+8OH--6e-=CO32-+6H2O,故答案为:CH3OH+8OH--6e-=CO32-+6H2O;
②CH3OH+8OH--6e-=CO32-+6H2O,氢氧根离子被消耗,所以溶液的pH减小,故答案为:减小;
③c电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,乙中电池反应式为2NaCl+2H2O=2NaOH+Cl2↑+H2↑,溶液中生成n(NaOH)=0.1mol/L×0.3L=0.03mol,转移电子的物质的量=0.03mol,串联电路中转移电子相等,所以消耗氧气体积=$\frac{0.03}{4}$×22.4=168mL;甲中阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成铜,
n(CuSO4)=0.25L×0.04mol/L=0.01mol,铜离子完全放电时转移电子0.02mol<0.04mol,所以阴极上还有部分氢气生成,所以相当于析出CuO和水,可以加入CD使溶液恢复原状,故选CD,
故答案为:2Cl--2e-=Cl2↑;168;CD.
点评 本题主要考查了根据盖斯定律、原电池和电解池原理来分析解答即可,题目难度不大,注意把握从键能的角度计算反应热的方法.


科目:高中化学 来源: 题型:选择题
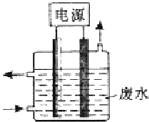 用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的PH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极附近碱性增强,阳极附近碱性减弱 | |
| D. | 除去CN-的反应:5ClO-+2CN-+2H+═N2↑+2CO2↑+5Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯储存在钢瓶中 | B. | 新制氯水保存在黑色广口瓶中 | ||
| C. | 少量金属钠保存在煤油中 | D. | 氯化亚铁溶液加入少量的铁粉保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
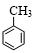 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$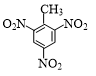 +3H2O.
+3H2O.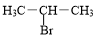 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$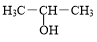 +NaBr.
+NaBr.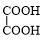 +
+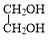 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 明矾常用于水体的净化、杀菌和消毒 | |
| C. | 热的纯碱溶液去污效果更好 | |
| D. | 84消毒液与洁厕灵混合后用于清洁洗手间的效果更好 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com