
向0.1mol/L的草酸(H2C2O4)溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色总是先慢后快。对其原因,某研究性学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究:
| 实验组别 | 试管标号 | 所加药品 | 实验现象 (褪色时间) |
| 一 (室温) | 1 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 + 少量硫酸锰固体 | 2s |
| 2 | 10ml 0.1mol/L的草酸(H2C2O4)溶液(用少量硫酸酸化)0.1mol/L的KMnO4溶液适量 | 30s | |
| 二 (室温) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液+10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 | 100s | |
| 三 (65℃ 的水浴) | 1 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的 KMnO4溶液 +10滴稀硫酸 | 90s |
| 2 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +1ml稀硫酸 | 100s | |
| 3 | 5ml 0.1mol/L的草酸(H2C2O4)溶液 5滴0.1mol/L的KMnO4溶液 +2ml稀硫酸 | 120s |
(1) 该研究性学习小组的实验目是: 。
(2)该研究性学习小组进行实验时所用的方法是科学实验中常用的一种方法,该方法
叫 法;
(3)设计第一组实验对应的假设是 ;
(4)由第二组实验和第三组实验得出的结论有 (填序号)
①温度对该反应速率影响不大
②硫酸对草酸和高锰酸钾溶液的反应有影响
③加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应,而加入大量硫酸,反应速率比较慢
④在酸性范围呢,PH值越小,可能对反应越有利
(5)据有关现象写出草酸溶液与酸性高锰酸钾溶液反应的离子方程式:
。
科目:高中化学 来源: 题型:阅读理解

| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
| 3 |
| 2 |
| 3 |
| 2 |
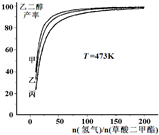 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=查看答案和解析>>
科目:高中化学 来源: 题型:
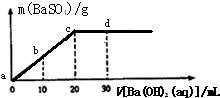 常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( )
常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com