
同一反应,反应物状态不同时
S(g)+O2(g)===SO2(g) ΔH1<0
S(s)+O2(g)===SO2(g) ΔH2<0
则ΔH1____ΔH2。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO 、NO
、NO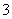 和少量Cr2O
和少量Cr2O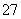 )回收与再利用工艺如下:
)回收与再利用工艺如下:

已知:①Cr(OH)3+OH-===CrO +2H2O;
+2H2O;
②2CrO +3H2O2+2OH-===2CrO
+3H2O2+2OH-===2CrO +4H2O;
+4H2O;
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。
(1)实验中所用KOH浓度为6 mol·L-1,现用KOH固体配制250 mL 6 mol·L-1的KOH溶液,除烧杯、玻璃棒外,还必需用到的玻璃仪器有________。
(2)滤液Ⅰ酸化前,进行加热的目的是________。冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是________________________。
(3)下表是相关物质的溶解度数据:
| 物质 | 0 ℃ | 20 ℃ | 40 ℃ | 60 ℃ | 80 ℃ | 100 ℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,操作Ⅰ具体操作步骤为①__________________、②__________。
(4)称取产品重铬酸钾试样2.000 g配成250 mL溶液,取出25.00 mL于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5 min,然后加入100 mL水,加入3 mL淀粉指示剂,用0.120 0 mol·L-1 Na2S2O3标准溶液滴定(I2+2S2O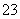 ===2I-+S4O
===2I-+S4O )。
)。
①若实验中共用去Na2S2O3标准溶液30.00 mL,所得产品中重铬酸钾的纯度为________(设整个过程中其他杂质不参与反应)。
②若滴定管在使用前未用Na2S2O3标准溶液润洗,测得的重铬酸钾的纯度将________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
制备单质锰的实验装置如图,阳极以稀硫酸为电解液,阴极以硫酸锰和硫酸混合液为电解液,电解装置中箭头表示溶液中阴离子移动的方向。下列说法不正确的是( )
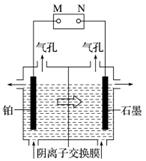
A.M是电源的负极
B.左侧气孔逸出的气体可能为副产物H2
C.电解槽中发生的总反应为MnSO4+2H2O MnO2+H2↑+H2SO4
MnO2+H2↑+H2SO4
D.若用阳离子交换膜代替阴离子交换膜,阳极可能得到MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
依据反应事实书写热化学方程式
依据事实,写出下列反应的热化学方程式。
(1)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和液态H2O。已知室温下2 g SiH4自燃放出热量89.2 kJ。SiH4自燃的热化学方程式为________________________________________________________________________
________________________________________________________________________。
(2)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在1 200 ℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+ O2(g)===SO2(g)+H2O(g) ΔH1
O2(g)===SO2(g)+H2O(g) ΔH1
2H2S(g)+SO2(g)=== S2(g)+2H2O(g) ΔH2
S2(g)+2H2O(g) ΔH2
H2S(g)+ O2(g)===S(g)+H2O(g) ΔH3
O2(g)===S(g)+H2O(g) ΔH3
2S(g)===S2(g) ΔH4
则ΔH4的正确表达式为( )
A.ΔH4=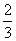 (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
B.ΔH4=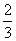 (3ΔH3-ΔH1-ΔH2)
(3ΔH3-ΔH1-ΔH2)
C.ΔH4= (ΔH1+ΔH2-3ΔH3)
(ΔH1+ΔH2-3ΔH3)
D.ΔH4= (ΔH1-ΔH2-3ΔH3)
(ΔH1-ΔH2-3ΔH3)
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)===CO(g)+3H2(g)
ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)===2CO(g)+2H2(g)
ΔH=247.4 kJ·mol-1
2H2S(g)===2H2(g)+S2(g)
ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。
CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________________________________________________________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是____________________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:_____________________________________________。
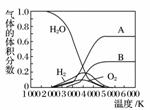
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如下图所示。图中A、B表示的物质依次是________________________。
(5)Mg2Cu是一种储氢合金。350 ℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同
B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同
C.已知:①2H2(g)+O2(g)===2H2O(g) ΔH1=-a kJ·mol-1,②2H2(g)+O2(g)===2H2O(l)
ΔH2=-b kJ·mol-1,则a>b
D.已知:①C(石墨,s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1,②C(金刚石,s)+O2(g)===
CO2(g) ΔH2=-395.0 kJ·mol-1,则金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL未知浓度的盐酸(酚酞作指示剂)的滴定曲线如图所示。下列说法正确的是( )
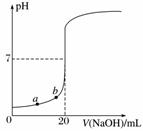
A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.010 0 mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL时(忽略反应前后体积变化),该混合液的pH=1+lg 3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com