
化合物A经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2.A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图.关于A的下列说法中,正确的是()

A. 与A属于同类化合物的同分异构体只有2种
B. A在一定条件下可与4 mol H2发生加成反应
C. A分子属于酯类化合物,在一定条件下不能发生水解反应
D. 符合题中A分子结构特征的有机物只有1种
考点: 常见有机化合物的结构;有机物的推断.
专题: 有机物的化学性质及推断.
分析: 有机物A的分子式为分子式C8H8O2,不饱和度为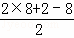 =5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为
=5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为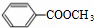 ,据此解答.
,据此解答.
解答: 解:有机物A的分子式为分子式C8H8O2,不饱和度为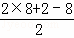 =5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为
=5,A分子中只含一个苯环且苯环上只有一个取代基,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,说明A含有四种氢原子且其原子个数之比为1:2:2:3,结合红外光谱可知,分子中存在酯基等基团,故有机物A的结构简式为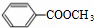 ,
,
A.属于同类化合物,应含有酯基、苯环,若为羧酸与醇形成的酯有:甲酸苯甲酯,若为羧酸与酚形成的酯,可以是乙酸酚酯,可以是甲酸与酚形成的酯,甲基有邻、间、对三种位置,故5种异构体,故A错误;
B.A在一定条件下可与3mol H2发生加成反应,故B错误;
C.A含有酯基,属于酯类化合物,在一定条件下能发生水解反应,故C错误;
D.符合题中A分子结构特征的有机物只有1种,故D正确;
故选D.
点评: 本题考查有机物结构的推断、核磁共振氢谱、红外光谱图、官能团性质等,难度中等,推断A的结构是解题的关键,注意结合分子式与红外光谱含有的基团进行判断.


科目:高中化学 来源: 题型:
已知下列元素原子的最外层电子排布式,其中不一定能表示该元素为主族元素的是( )
|
| A. | 3s23p3 | B. | 4s2 | C. | 4s24p1 | D. | 3s23p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是元素周期表的一部分.原子序数为10的元素名称为 ;氟原子的核外电子数为 ,等质量的氧气和氟气中,所含原子数较少的是 .
| 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e﹣═4OH﹣
C. 每转移0.1 mol电子,消耗标准下1.12 L的H2
D. H+由b极通过固体酸电解质传递到a极
查看答案和解析>>
科目:高中化学 来源: 题型:
用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ•mol﹣1CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1 160kJ•mol﹣1若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移电子总数为 (阿伏加德罗常数的值用NA表示),放出的热量为 kJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
A. 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2
B. 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
C. 油脂不是高分子化合物,1 mol油脂完全水解生成1 mol甘油和3 mol高级脂肪酸
D. 欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热
查看答案和解析>>
科目:高中化学 来源: 题型:
霉酚酸酯(MMF)是器官移植中抑制细胞增殖最常用的药物.下列关于MMF的说法不正确的是()
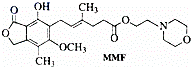
A. MMF不能溶于水
B. MMF能发生取代反应和消去反应
C. 1molMMF能与4mol氢气发生加成反应
D. 1molMMF能与含3molNaOH溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,两圆圈相交的部分表示圆圈内的物质相互发生的反应.已知钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是()
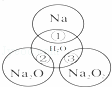
A. 反应③最多能产生0.05mol O2
B. 反应①的离子方程式为:Na+2H2O═Na++2OH﹣+H2↑
C. Na2O2中阴阳离子数目之比为1:1
D. ①、②、③充分反应后所得溶液的质量分数从大到小:①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) .
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) .
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH﹣)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol.
② 和 两种粒子的物质的量之和比OH﹣多0.05mol.
(4)已知某溶液中只存在OH﹣、H+、NH4+、Cl﹣四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣) B.c(Cl﹣)>c(NH4+)>c(OH﹣)>c(H+)
C.c(Cl﹣)>c(H+)>c(NH4+)>c(OH﹣) D.c(NH4+)>c(Cl﹣)>c(OH﹣)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) .
②若上述关系中C是正确的,则溶液中溶质的化学式是 .
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3•H2O),混合后溶液中c(NH4+)与c(Cl﹣)的关系c(NH4+) c(Cl﹣).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com