
| A. | 甲中沉淀一定比乙多 | B. | 甲和乙中沉淀可能一样多 | ||
| C. | 甲中沉淀可能比乙多 | D. | 乙中沉淀一定比甲多 |
分析 氢氧化铝能溶于氢氧化钠但不溶于氨水,故开始加入时,两烧杯中生成的都是氢氧化铝沉淀;
相同体积、相同pH的两溶液中的溶质一水合氨大于氢氧化钠:
当两者均不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠不足量时,生成的沉淀氨水多;
氨水过量,氢氧化钠恰好时,生成的沉淀一样多;
氨水和氢氧化钠都过量时,生成的沉淀氨水多.
解答 解:因氨水和NaOH溶液中,各加入10mL 0.1mol•L-1 AlCl3溶液,生成氢氧化铝沉淀,但氨水为弱电解质,部分电离,氢氧化钠为强电解质,完全电离,相同体积、相同pH的氨水和NaOH溶液中的溶质一水合氨的物质的量大于氢氧化钠的物质的量;
当两者都不足量时,生成的氢氧化铝沉淀的量由一水合氨和氢氧化钠来决定,一水合氨的物质的量大于氢氧化钠的物质的量,所以甲中沉淀比乙中的少;
当氨水过量,氢氧化钠不足时,乙中生成的氢氧化铝的物质的量为10mL×10-3L/mL×0.1mol•L-1=0.001mol,甲中生成的氢氧化铝的物质的量小于0.001mol,所以甲中沉淀比乙中少;
当氨水过量,氢氧化钠恰好时,生成的沉淀取决于氯化铝,氯化铝的量相等,所以甲和乙中生成的沉淀一样多;
当氨水和氢氧化钠都过量时,因氢氧化铝能溶于氢氧化钠但不溶于氨水,乙中生成的氢氧化铝为0.001mol,甲中生成的氢氧化铝溶于过量的氢氧化钠,氢氧化铝沉淀小于0.001mol,所以甲中沉淀比乙中少.
通过以上分析知,甲中沉淀少于或等于乙中沉淀,故ACD错误、B正确;
故选B.
点评 本题考查了铝化合物性质、化学计算等,此题解答时,根据氢氧化铝的性质采用讨论的方法进行解答,能正确进行分段是解本题的关键,题目难度中等,侧重于考查学生的分析能力.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
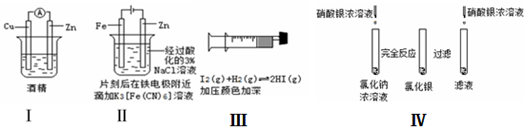
| A. | 方案Ⅰ验证金属活泼性:Zn>Cu | |
| B. | 方案Ⅱ验证Fe电极被保护 | |
| C. | 方案Ⅲ验证平衡移动原理 | |
| D. | 方案Ⅳ验证氯化银在水中存在溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
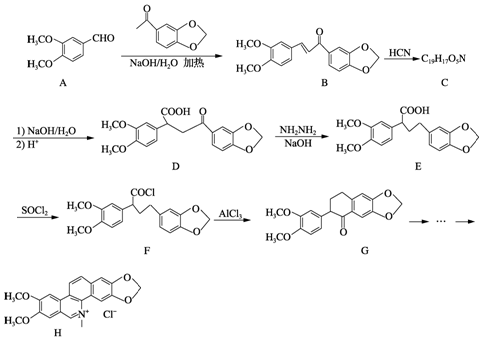
 ;由E→F的反应类型为取代.
;由E→F的反应类型为取代. .
. ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)?
(g)? (g)+H2 △H=+124KJ•mol-1
(g)+H2 △H=+124KJ•mol-1| 化学键 | C-H | C-C | C=C | H-H |
| 键能/KJ/mol | 412 | 348 | X | 436 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(G)△H2>0
(g)+HCl(G)△H2>0
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题:
A、B、C、D、E、R为原子序数依次增大的六种元素,位于元素周期表的前四周期.B元素原子含有3个能级,且每个能级所含的电子数相同;D的原子核外有8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子3d轨道上有4个未成对电子.请回答下列问题: ,F基态原子的外围电子排布式3d104s1.
,F基态原子的外围电子排布式3d104s1.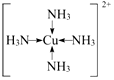 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com