
【题目】将等量的CO(g)和H2O(g)分别通入到容积为2 L的恒容密闭容器中进行如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到下列数据:
CO2(g)+H2(g),得到下列数据:
实验组 | 温度 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 2 | 4 | 0.9 | t |
①在实验1中,以v(CO2)表示该反应前5分钟的平均反应速率为________; __________;平衡时的压强和反应开始的压强之比为__________。
②在实验2中,t________5(填“大于”“小于”或“等于”)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列对实验仪器特点的描述正确的或实验能达到预期目的的是( )
A.托盘天平标尺的“0”刻度在中间
B.量筒的“0”刻度在下面
C.用10 mL量筒去量取7.50 mL稀盐酸
D.用托盘天平称量25.2 g NaCl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池具有比能量高、无污染的特点,用下图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )
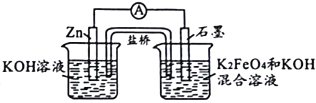
A. 放电时,电子由正极通过外电路流向负极
B. 放电时,负极上的电极反应式为:Zn-2e ─+2H2O = Zn(OH)2+2H+
C. 充电时,阴极区溶液的pH减小
D. 充电时,阳极上的电极反应式为:Fe(OH)3-3e ─+5OH ─ = FeO42 ─+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方法能达到实验目的的是
A. 用淀粉溶液检验溶液中是否存在碘化钾
B. 用分液漏斗分离苯与酒精的混合物
C. 用氯化钡溶液鉴别碳酸钠溶液与硫酸钠溶液
D. 用丁达尔效应区分氢氧化铁胶体和FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子。离子浓度均为0.3mol·L-1。某同学进行了如下实验:
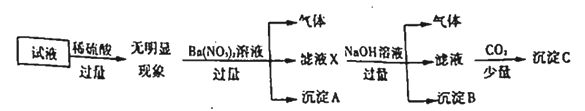
下列说法正确的是
A. 无法确定原试液中是否含有Al3+、Cl-
B. 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42-
C. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
D. 无法确定沉淀C的成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO的燃烧热为akJ/mol,将CO燃烧产物通入一定浓度的NaOH溶液中,所得溶液中溶质仅为Na2CO3,浓度为0.01mol/L。
(1)写出CO完全燃烧的热化学方程式__________________________;
(2)Na2CO3溶液呈碱性,可以用来去油污,用离子方程式表示Na2CO3呈碱性的原因___________________________________;
(3)写出Na2CO3溶液中的电荷守恒关系__________;(用离子浓度符号表示)
(4)计算在该浓度的Na2CO3溶液中c(CO32-)+c(HCO3-)+c(H2CO3)=____mol/L
(5)向该溶液中滴加AlCl3溶液,会有气泡和白色沉淀生成,写出发生反应的离子方程式__________________________。
(6)已知Cu(OH)2的溶度积为Ksp=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于________;要使0.2 mol·L-1 CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明按下图装好了实验装置(两胶头滴管中的过氧化氢溶液体积相等,浓度分别为5%和10%),实验时,同时完全捏扁两滴管的胶头,并观察实验现象。
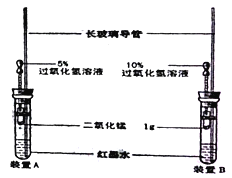
(1)小明的实验目的是:__________________________。
(2)装置中长玻璃导管的作用是:_________________;红墨水的作用是________。
(3)你估计两根玻璃导管中的实验现象是_____________;理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是 ( )
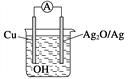
A. 2 mol Cu与1 mol Ag2O的总能量低于1 mol Cu2O与2 mol Ag具有的总能量
B. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
C. 测量原理示意图中,电流方向从Cu→Ag2O
D. 电池工作时,OH-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为实现实验目的,选用的装置、实验操作均正确的是( )
实验目的 | 实验步骤和装置 | |
A | 探究温度对反应速率的影响 | 不同温度下,取0.1 mol/LKI 溶液,向其中先加入淀粉溶液,再加入0.1 mol/L 硫酸,记录溶液出现蓝色的时间 |
B | 配制100mL1.0mol/L NaOH溶液 | 向100mL容量瓶中加入4. 0gNaOH固体,加水到刻度线 |
C | 验证牺牲阳极的阴极保护法 |
往铁电极附近滴加铁氰化钾溶液 |
D | 比较H2O2 和Fe3+的氧化性 | 将盐酸酸化的双氧水滴入Fe(NO3)2溶液中 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com