
【题目】用如图所示装置检验乙烯时不需要除杂的是( ) 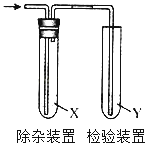
乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
C | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | KMnO4酸性溶液 |
D | CH3CH2OH与浓H2SO4加热至170℃ | NaOH | Br2的CCl4溶液 |
A.A
B.B
C.C
D.D
【答案】B
【解析】解:A.溴乙烷的消去反应: 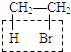 +NaOH
+NaOH ![]() CH2=CH2↑+NaBr+H2O,利用KMnO4+CH2═CH2+H2SO4→CO2↑+K2SO4+MnSO4+H2O,导致酸性KMnO4溶液褪色,检验乙烯;但乙烯中含有杂质乙醇,乙醇能与KMnO4酸性溶液反应,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4 , 使KMnO4酸性溶液褪色,故需用水分离,乙醇能和水任意比互溶,而乙烯难溶于水,故A正确; B.乙醇易挥发,CH3CH2Br与NaOH乙醇溶液共热:
CH2=CH2↑+NaBr+H2O,利用KMnO4+CH2═CH2+H2SO4→CO2↑+K2SO4+MnSO4+H2O,导致酸性KMnO4溶液褪色,检验乙烯;但乙烯中含有杂质乙醇,乙醇能与KMnO4酸性溶液反应,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4 , 使KMnO4酸性溶液褪色,故需用水分离,乙醇能和水任意比互溶,而乙烯难溶于水,故A正确; B.乙醇易挥发,CH3CH2Br与NaOH乙醇溶液共热: 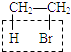 +NaOH
+NaOH ![]() CH2=CH2↑+NaBr+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,含有的杂质乙醇,乙醇不与Br2的CCl4溶液反应,无需分离乙醇和乙烯,故B错误;
CH2=CH2↑+NaBr+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,含有的杂质乙醇,乙醇不与Br2的CCl4溶液反应,无需分离乙醇和乙烯,故B错误;
C.乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,CH3﹣CH2﹣OH ![]() CH2═CH2↑+H2O,同时乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,反应为C2H5OH+2H2SO4
CH2═CH2↑+H2O,同时乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,反应为C2H5OH+2H2SO4 ![]() 2C+2SO2↑+5H2O,含有杂质乙醇、二氧化硫、二氧化碳,二氧化硫、乙醇能与KMnO4酸性溶液反应,2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4 , 导致酸性KMnO4溶液褪色,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4 , 使KMnO4酸性溶液褪色,故需用NaOH溶液分离,NaOH溶液能溶解乙醇,能和二氧化硫反应,故C正确;
2C+2SO2↑+5H2O,含有杂质乙醇、二氧化硫、二氧化碳,二氧化硫、乙醇能与KMnO4酸性溶液反应,2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4 , 导致酸性KMnO4溶液褪色,5C2H5OH+4KMnO4 +6H2SO4→5CH3COOH+4MnSO4+11H2O+2K2SO4 , 使KMnO4酸性溶液褪色,故需用NaOH溶液分离,NaOH溶液能溶解乙醇,能和二氧化硫反应,故C正确;
D.乙醇在浓硫酸加热170℃发生消去反应生成乙烯气体,CH3﹣CH2﹣OH ![]() CH2═CH2↑+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,同时乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,反应为C2H5OH+2H2SO4
CH2═CH2↑+H2O,利用CH2=CH2+Br2→CH2BrCH2Br溶液褪色检验乙烯,同时乙醇和浓硫酸在170℃以上能发生氧化反应,生成黑色碳、二氧化硫气体和水,反应为C2H5OH+2H2SO4 ![]() 2C+2SO2↑+5H2O,含有杂质乙醇、二氧化硫、二氧化碳,二氧化硫能与Br2的CCl4溶液反应,SO2+2H2O+Br2═H2SO4+2HBr,乙醇与水互溶,二氧化碳不影响乙烯的检验,需用氢氧化钠除去二氧化硫,故D正确;
2C+2SO2↑+5H2O,含有杂质乙醇、二氧化硫、二氧化碳,二氧化硫能与Br2的CCl4溶液反应,SO2+2H2O+Br2═H2SO4+2HBr,乙醇与水互溶,二氧化碳不影响乙烯的检验,需用氢氧化钠除去二氧化硫,故D正确;
故选B.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中Fe3+还原成Fe2+ , 有利于人体吸收.
(1)在人体中进行Fe2+ ![]() Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂.
Fe3+的转化时,①中的Fe2+作剂,②中的Fe3+作剂.
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作剂.
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(HCl)的作用下转化成亚铁盐,此反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学科学的说法,正确的是:
A.化学是在质子变化的层次上研究物质的一门基础学科
B.化学学科的特征是从宏观和微观两个角度认识物质
C.化学学科研究物质性质但不能创造出新物质
D.化学学科表征物质的方法与物理学科完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
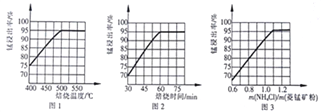
【题目】工业上采用氨化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
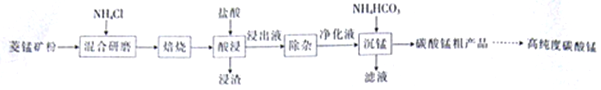
已知相关信息如下:
①菱锰矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3.2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应:MnCO3+2NH4C1![]() MnCl2+2NH3↑+CO2↑+H2O。
MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物 | Mn(OH)2 | MnCO3 | CaF2 | MgF2 |
Ksp | 2.0×10-13 | 2.0×10-11 | 2.0×10-10 | 7.0×10-11 |
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、![]() 分别为_____、_____、_____、。
分别为_____、_____、_____、。
(2)“除杂“过程如下:
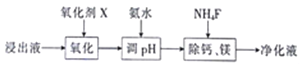
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O8>H2O2>Cl2>MnO2>Fe3+,则氧化剂X宜选择_______(填字母)。
A. (NH4)2S2O8 B.MnO2 C.H2O2 D. Cl2
②调节pH时,pH可取的最低值为________。
③当CaF2、MgF2 两种沉淀共存时,若溶液中c(Ca2+) =1.0×10-5mol/L,则c(Mg2+) =_____mol/L。
(3)“沉锰”过程中,不用碳酸钠溶液替代NH4HCO3溶液,可能的原因是____________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL作锥形瓶中,加少量水湿润。再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为Mn(PO4)2]3-,多余的硝酸铵全部分解。用氨气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定,发生的反应为:
[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3+ +2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2 , 此外还含Fe3+、Fe2+和Mn2+等离子.若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁.
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,填写空白:
表1生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
Fe2+氢氧化物呈絮状,不易从溶液中除去,常将它氧化为Fe3+ , 生成Fe(OH)3沉淀除去.
表2原料价格表
物质 | 价格/元吨﹣1 |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
(1)在步骤②中加入的试剂X,最佳的选择是 , 其作用是;
(2)在步骤③中加入的试剂应是;之所以要控制pH=9.8,其目的是;
(3)在步骤④中加入的试剂Z应是;
(4)在步骤⑤中发生的反应是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各元素组中,除一种元素外,其余都可以按照某种共性归属为一类,请选出各组的例外元素,并将该组其他元素的可能归属按所给六种类型的编号填入表中。
其他元素可能归属类型:①主族元素;②过渡元素;③同周期元素;④同主族元素;⑤金属元素;⑥非金属元素。_____________、___________________、_____________、___________________、_____________、___________________、_____________、___________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.SO2的水溶液能导电,所以SO2是电解质
B.酸式盐的水溶液呈酸性
C.醋酸溶液中醋酸的电离程度随温度的升高而增大
D.FeCl3的溶液加热蒸干可得到FeCl3的晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com