
分析 浓硝酸和铜反应生成硝酸铜、二氧化氮和水;浓硝酸和铜反应随反应进行浓度变稀,铜和稀硝酸反应生成硝酸铜、一氧化氮和水;铜有剩余说明硝酸全部反应,加入硫酸提供氢离子在溶液中和硝酸根离子形成稀硝酸继续和铜反应生成一氧化氮气体,以此解答该题.
解答 解:浓硝酸和铜反应生成硝酸铜、二氧化氮和水,反应的化学方程式为:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O;
浓硝酸和铜反应随反应进行浓度变稀,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,发生3Cu+8HNO3(浓)═3Cu(NO3)2+2NO↑+4H2O;
铜有剩余说明硝酸全部反应,加入硫酸提供氢离子在溶液中和硝酸根离子形成稀硝酸继续和铜反应生成一氧化氮气体,形成了氧化还原反应的条件,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
答:在一盛有3mL浓硝酸的试管中放入过量铜片,HN03能反应完,生成的气体是NO2、NO,此情况下,当反应完全停止之后,再向试管中加入少量稀H2SO4,又有气体产生,生成NO,原因是硫酸提供氢离子在溶液中和硝酸根离子形成稀硝酸继续和铜反应生成一氧化氮气体.
点评 本题考查了硝酸性质的分析应用,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


科目:高中化学 来源: 题型:多选题
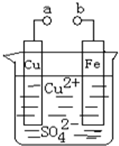
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+ | |
| C. | a和b用导线连接时电子从Cu片流向铁片 | |
| D. | a和b用导线连接时,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 4 | 2 | 0 | 0 | 放出热量:Q1 |
| 乙 | 3 | 1.5 | 1 | 0 | 放出热量:Q2 |
| 丙 | 3 | 1.5 | 1 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3=394 kJ | |
| B. | 若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1<-197 kJ•mol-1 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 达到平衡时,丙容器中SO2的体积分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HOCH2CH2CHO | |
| B. | 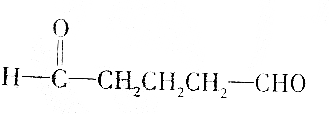 | |
| C. | 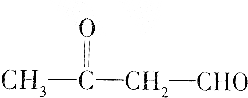 | |
| D. | 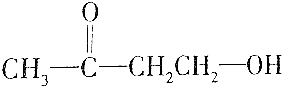 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数kP=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的物质的量分别为4nol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/浓度 | c(NH3)(mol•L-1) | c(O2)(mol•L-1) | c(NO)(mol•L-1) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
| 第10min | 0.7 | 1.475 | 0.1 |
| A. | 第4min、第8min时分别达到化学平衡,且平衡常数相同 | |
| B. | 反应在第2min时改变了某一条件,该条件一定是升高温度 | |
| C. | 反应在第2min到第4min时,O2的平均速率为0.1875mol•min-1 | |
| D. | 在开始反应的前2min内,该反应放出0.2QKJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在浓硫酸加热140℃条件下反应 | |
| B. | 乙醇与乙酸反应制乙酸乙酯 | |
| C. | 石油裂解制丙烯 | |
| D. | 氯乙烷在氢氧化钠水溶液中加热生成乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com