
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH="-99" kJ·mol-1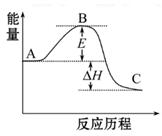
请回答下列问题:
(1)图中A、C分别表示_________、_________,E的大小对该反应 的反应热有无影响?_________。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_________,理由是__________________;(2)图中ΔH=_________kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物VO2;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式_____________________________;
(4)已知单质硫的燃烧热为296 kJ·mol-1,计算由S(s)生成3mol SO3(g)的ΔH_______(要求计算过程)。
(1)反应物能量 生成物能量 没有影响 降低 因为催化剂改变了反应历程,使活化能E降低
(2)-198
(3)SO2+V2O5====SO3+2VO2 4VO2+O2====2V2O5
(4) -1 185 kJ·mol-1
解析试题分析:本题考查化学反应中的能量变化、盖斯定律、反应速率计算及催化剂的催化原理。(1)由图象知A、C点分别代表反应物、产物的总能量,E为反应的活化能,因反应历程不同而不同,但对反应热无影响;催化剂的加入,改变了反应历程,降低了反应的活化能,从而加快了反应速率。(2)由已知数据可知ΔH="-99" kJ·mol-1×2="-198" kJ·mol-1。 (4硫的燃烧热为296 kJ·mol-1,可得S(s)+O2(g)====SO2(g),ΔH="-296" kJ·mol-1,结合2SO2(g)+O2(g) 2SO3(g),ΔH="-198" kJ·mol-1,利用盖斯定律,即可求得由S(s)生成3 mol SO3(g)的ΔH。
2SO3(g),ΔH="-198" kJ·mol-1,利用盖斯定律,即可求得由S(s)生成3 mol SO3(g)的ΔH。
S(s)+O2(g)====SO2(g) △H1="-296" kJ·mol-1①
SO2(g)+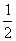 O2(g)====SO3(g) △H2="-99" kJ·mol-1②
O2(g)====SO3(g) △H2="-99" kJ·mol-1②
①×3+②×3得
3S(s)+ O2(g)====3SO3(g) ΔH=(ΔH1+ΔH2)×3="-1" 185 kJ·mol-1
O2(g)====3SO3(g) ΔH=(ΔH1+ΔH2)×3="-1" 185 kJ·mol-1
考点:考查化学反应与能量、盖斯定律、反应速率计算及催化剂的催化原理相关知识点


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
已知反应A+B= C+D的能量变化如下图所示,下列说法正确的是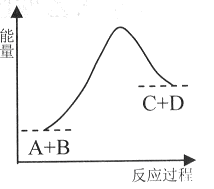
| A.该反应是放热反应 |
| B.只有在加热条件下才能进行 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应中断开化学键吸收的总能量高于形成化学键放出的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关热化学方程式的叙述正确的是 ( )
| A.已知2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为-285.8 kJ/mol |
| B.已知C(石墨,s)===C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol |
| D.已知2C(s)+2O2(g)===2CO2(g) ΔH1;2C(s)+O2(g)===2CO(g) ΔH2,则ΔH1>ΔH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)(1)在25℃、101kPa下,1g甲烷燃烧生成CO2和液态水时放热55.6kJ。则表示甲烷燃烧热的热化学方程式为_________________________________________________。
(2)下表中的数据表示破坏1 mol化学键需消耗的能量(即键能,单位为kJ·mol-1):
| 化学键 | C—H | C—F | H—F | F—F |
| 键能 | 414 | 489 | 565 | 158 |
 Al(OH)3(aq)
Al(OH)3(aq) Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;
Al3+(aq)+3OH-(aq),前段为溶解平衡,后段是电离平衡;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(共12分)(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出257.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
①反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(4分)拆开1mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。下表是某些共价键的键能:
| 共价键 | H-H | O=O | H-O |
| 键能/kJ ·mol-1 | 436 | 498 | X |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
;实验a和c的平衡转化率:αa为 、αc为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1、CH3OH(l)+ 3/2O2(g)= CO2 (g)+ 2H2O(l) ΔH=-726.5 kJ·mol-1、CO(g) +1/2O2(g)= CO2 (g) ΔH=-283.0 kJ·mol-1。
请回答下列问题:
⑴用太阳能分解18g水,需要消耗的能量为 kJ。
⑵ 液态CH3OH不完全燃烧生成CO和液态H2O的热化学方程式为 。
⑶CO2合成燃料CH3OH是碳减排的新方向。在容积为2 L的密闭容器中,充2 mol CO2和6 mol H2,由CO2和H2合成甲醇,反应式:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300 ℃):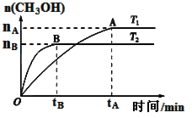
①下列说法正确的是
A.温度为T2时,从反应开始到平衡,生成甲醇的平均速率为: v(CH3OH)=nB/tB mol·(L·min)-1
B.T2>T1,T2平衡时,甲醇产量变少,所以该反应为放热反应
C.该反应在T2时的平衡常数比T1时的平衡常数大
D.处于A点的反应体系从T1变到T2,平衡逆向移动
②能判断该反应已达化学反应限度标志的是 (填字母。
A.H2的百分含量保持不变
B.容器中CO2 浓度与H2浓度之比为1: 3
C.容器中混合气体的密度保持不变
D.CO2消耗速率与CH3OH生成速率相等
⑷科学家致力于CO2的“组合转化”技术研究,如将CO2和H2以体积比1∶4比例混合通入反应器,适当条件下,反应可获得一种能源。完成以下化学方程式,就能知道该种能源。
CO2+4H2 2H2O + 。
2H2O + 。
⑸ 在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,总反应式为:2CH3OH + 3O2=2CO2+4H2O,则正极的反应式为 ;负极的反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com