
【题目】常见物质A~K之间存在如图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
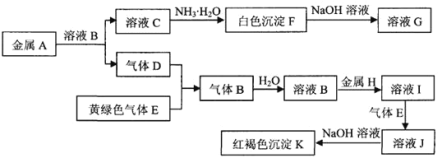
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
【答案】AlCl3 Fe 2Fe2++Cl2=2Fe3++2Cl- 在试管中取少量J溶液,向其中滴加几滴KSCN溶液,振荡,若溶液变为红色,则说明J溶液含有Fe3+
【解析】
溶液C与氨水反应生成白色沉淀F,白色沉淀F与氢氧化钠溶液反应生成溶液G,说明G为NaAlO2,F为Al(OH)3,金属A与溶液B反应生成气体D,金属A为Al,气体D和黄绿色气体E(Cl2)反应生成气体B,气体B溶于水,溶液B与金属H反应生成溶液I,根据后面红褐色沉淀,得到金属H为Fe,则B为HCl,溶液C为AlCl3,则D为H2,溶液I为FeCl2,溶液J为FeCl3,K为Fe(OH)3。
(1)根据前面分析得到物质的化学式是:C为AlCl3,H为Fe;
(2)反应“I→J”是Fe2+与Cl2反应生成Fe3+和Cl-,其离子方程式是2Fe2++Cl2=2Fe3++2Cl-;
(3)检验J溶液中的金属离子的方法是主要是用KSCN溶液检验铁离子,变红,说明溶液中含有铁离子。


科目:高中化学 来源: 题型:
【题目】如图为铜锌原电池的示意图,下列说法错误的是
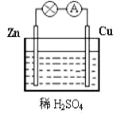
A. 一段时间后,锌片逐渐溶解,质量减小
B. 该装置能将电能转化为化学能
C. 将铜片换成石墨棒,灯泡亮度不变
D. 铜不参与氧化还原反应,只起导电作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) 的能量变化如图所示,下列有关叙述中正确的是

A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.断裂1 mol H—H键和1 mol F—F 键吸收的能量大于形成2 mol H—F键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某水溶液M中存在的粒子有Na+、A2-、HA-、H+、OH-、H2O和H2A。根据题意回答下列问题:
(1)H2A为_____酸(填“强”或“弱”),往H2A溶液中加水会使 c(H+)/c(H2A)的值________(填“增大”、“减小”或“不变”)。
(2)若M是由一种溶质组成的溶液,则M的溶质可以是Na2A或________。
①Na2A的水溶液pH________(填“<”、“>”或“=”)7,
原因是:______________________________(用离子方程式表示)
②往Na2A溶液中加入_______________可抑制其水解(选填字母序号)。
a.氯化铵固体 b.KOH固体 c. 水 d.升高温度
③已知Ksp(CuA)=1.3×10-36,往20mL 1 mol·L-1Na2A溶液中加入10 mL 1 mol·L-1 CuCl2溶液,混合后溶液中的Cu2+浓度为________mol·L-1。(忽略A2-的水解)
(3)若溶液M由10 mL 1.00 mol·L-1 H2A溶液与10 mL 1.00 mol·L-1 NaOH溶液混合而成,下列关于溶液M的说法正确的是________(选填字母序号)。
a.c(A2-) + c(HA-) + c(H2A) = 1 mol·L-1
b.若溶液显酸性,则c(Na+)>c(HA-) >c(H+)>c(A2-) >c(OH-)
c.离子浓度关系:c(Na+) + c(H+) = c(OH-) + c(HA-) + c(A2-)
d.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
(4)浓度均为0.1 mol · L-1的Na2A、NaHA混合溶液中: ![]() = ______ 。
= ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体置于1L的密闭容器中,混合后发生如下反应:2A(g)+B(g)=2C(g)。若经2s后测得C的浓度为1.2mol/L,下列说法正确的是()
A.用物质A表示的反应速率为1.2mol/(L·s)B.2s时物质A的转化率为30%
C.用物质B表示的反应速率为0.6mol/(L·s)D.2s时物质B的浓度为0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D是同周期中原子半径最小的元素 |
E | E元素在同周期中金属性最强 |
F | F元素的最外层电子数等于周期序数 |
G | G元素原子M层上电子数比L上少2个电子。 |
(1)G在元素周期表中的位置________。
(2)B最简单气态氢化物的结构式____,属于____化合物(填“离子”或“共价”);E的最高价氧化物的水化物电子式____,所含化学键类型________。
(3)C、D、E、F、G简单离子半径由大到小顺序为:____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程______。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是_______。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。

下列分析正确的是
A. 原H2S溶液的物质的量浓度为0.05 mol/L
B. 氢硫酸的酸性比亚硫酸的酸性强
C. b点水的电离程度比c点水的电离程度大
D. a点对应溶液的导电性比d点强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一个原子形成的离子可表示为![]() n-,下列说法正确的是( )
n-,下列说法正确的是( )
A.![]() n-中含有的中子数为a+b
n-中含有的中子数为a+b
B.![]() n-中含有的电子数为a-n
n-中含有的电子数为a-n
C.X原子的质量数为a+b+n
D.一个X原子的质量约为![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中所处的位置如图所示。A、B、C三种元素原子的质子数和为32。D元素原子的最外层电子数是其次外层电子数的2倍。则下列说法正确的是

A. 元素D的某种同位素质量数为14,则其中子数为6
B. 四种元素形成的气态氢化物中,C元素的氢化物的稳定性最强
C. B、C两种元素可形成BC6型化合物,该化合物属于离子化合物
D. A、B两种元素的气态氢化物均能与它们对应的最高价氧化物对应的水化物发生反应,且都属于氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com