
【题目】同温同压下,1 mol H2和1 mol O2,下列有关它们的说法正确的是
A. 质量相同,体积不同 B. 分子数相同,质量不同
C. 体积相同,分子数不同 D. 体积相同,原子数不同
科目:高中化学 来源: 题型:
【题目】扑热息痛是一种优良的解热镇痛剂,其结构简式为 ,以下对它的叙述中错误的是( )
,以下对它的叙述中错误的是( )
A. 能与烧碱溶液反应
B. 能与浓溴水发生取代反应
C. 能发生水解反应
D. 能发生加聚反应形成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应不符合绿色化学原子经济性要求的是( )
A. ![]() +HCl→CH2=CHCl
+HCl→CH2=CHCl
B. CH2=CH2+1/2O2![]()
![]()
C. ![]() +Br2
+Br2![]() +HBr
+HBr
D. CH2=CH2+HCl→CH3CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】思维辨析:
(1)互为同分异构体的不同物质相对分子质量相等,相对分子质量相等的不同物质一定互为同分异构____。
(2)氰酸(H—O—C≡N)和雷酸(H—N==C==O)都是无机物,它们互为同分异构体____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) 2P+5Cl2(过量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl, 遇O2生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________________________。
(2)实验室用二氧化锰和浓盐酸反应制备Cl2的离子方程式__________________________。实验过程中,为减少PCl5的生成,应控制____________________________________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解;二是吸收多余的Cl2,防止污染环境。写出PCl3遇水反应的化学方程式____________________________________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________________________________________________________________________。
(5)测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.1000 mol·L-120.00 mL碘溶液,充分反应后再用0.1000 mol·L-1Na2S2O3溶液滴定过量的碘,以淀粉溶液作指示剂,终点时消耗12.00 mL Na2S2O3溶液。已知:H3PO3+H2O+I2=H3PO4+2HI;I2+2Na2S2O3=2NaI+Na2S4O6;假设测定过程中没有其它反应。滴定终点的现象是:____________________________________________。根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学的形成、发展与应用过程中,下列科学家与其成就不相对应的是
A.1961年英国科学家波义尔提出化学元素的概念
B.1774年法国科学家拉瓦锡提出燃烧的氧化学说
C.1811年意大利科学家阿伏加德罗提出原子学说
D.1943年,科学家侯德榜发明联合制碱法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;
②单位时间内生成a mol A,同时生成3a mol B;
③气体密度不再变化;
④混合气体的总压强不再变化;
⑤A、B、C的物质的量之比为1∶3∶2;
⑥混合气体的平均相对分子质量不变
A. ②④⑤ B. ①③④⑥ C. ①②④⑥ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是 ( )
A.制备溴苯时,将苯与溴水混合,剧烈振荡
B.除去甲烷中混有的二氧化碳时,依次通过烧碱溶液和浓硫酸
C.在酸性高锰酸钾溶液中滴加几滴苯,用力振荡,紫红色褪去
D.在苯中通氢气制备环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,甲容器有一个移动活塞,能使容器保持恒压。起始时向甲中充入2 mol SO2、1 mol O2,向乙中充入4mol SO2、2 mol O2。甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,.关闭活塞K,使两容器中各自发生下述反应:2 SO2(g)+O2(g)![]() 2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
2SO3(g)。达平衡时,甲的体积为0.8L。下列说法正确的是
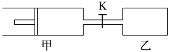
A.乙容器中SO2的转化率小于60%
B.平衡时SO3的体积分数:甲>乙
C.打开K后一段时间.再次达到平衡.甲的体积为1.4 L
D.平衡后向甲中再充入2mol SO2、1mol O2和3moLSO3,平衡向正反应方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com