
| A. | △H1-△H2<0 | |
| B. | 反应②为放热反应 | |
| C. | 3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=-103.0 kJ•mol-1 | |
| D. | 3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1 |
分析 A.△H1-△H2为$\frac{1}{2}$O2(g)+H2(g)=H2O(g)的反应热;
B.反应②:C(s)+H2O(g)=CO(g)+H2(g)为吸热反应;
C.根据盖斯定律可得3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=340.0 kJ•mol-1;
D.根据盖斯定律可得3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1.
解答 解:A.△H1-△H2为:$\frac{1}{2}$O2(g)+H2(g)=H2O(g)化合反应,为放热反应,故A正确;
B.反应②:C(s)+H2O(g)=CO(g)+H2(g)为吸热反应,故B错误;
C.根据盖斯定律:⑤×2-④×3得3CH3OCH3(g)=2CH3CH=CH2(g)+3H2O(g)△H=340.0 kJ•mol-1,故C错误;
D.根据盖斯定律:③×3+⑤得3CO(g)+6H2(g)=CH3CH=CH2(g)+3H2O(g)△H=-301.3kJ•mol-1,故D正确.
故选AD.
点评 本题考查了热化学方程式的书写方法和盖斯定律的应用,注意物质状态的标注和焓变的计算,题目难度不大.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
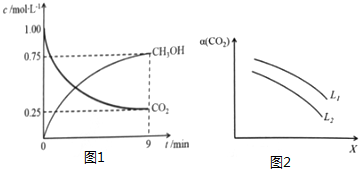 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点..“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.(1)将CO2转化成有机物可有效实现碳循环.CO2转化成有机物的例子很多,如:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 锌与硫酸铜溶液反应:Zn+Cu2+=Zn2++Cu | |
| C. | 碳酸钙与稀盐酸反应:CaCO3+2H +=Ca2++H2O+CO2↑ | |
| D. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-+H++OH-=H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
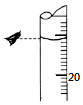 某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | 1.34 | 19.39 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
| Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
| Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
| Ⅲ | 0.32 | 1.0 | 0 | 0 | |
| Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
| A. | 容器Ⅳ中c(D)=0.4 mol/L | |
| B. | t2时容器Ⅱ中v(正)>v(逆) | |
| C. | 容器Ⅰ中平均反应速率v(B)=$\frac{0.04}{{t}_{1}}$mol/(L•min) | |
| D. | 容器Ⅲ中反应至平衡时吸热20 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④⑥⑦⑧ | B. | ①③⑦ | C. | ①③④⑤⑥⑧ | D. | ①②③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com