
【题目】在5L的密闭容器中进行以下反应:4NH3+5O2=4NO+6H2O,半分钟后冷却至室温,测得NO的物质的量增加了0.3mol,则此反应的平均反应速率υ(X)为( )
A. υ(H2O)=0.12mol·L-1·min-1B. υ(O2)=0.30mol·L-1·min-1
C. υ(NO)=0.008mol·L-1·s-1D. υ(NH3)=0.002mol·L-1·s-1
科目:高中化学 来源: 题型:
【题目】电子工业常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。从腐蚀废液(主要含FeCl3、FeCl2、CuCl2 )中回收铜,并重新获得FeCl3溶液。废液处理流程如下:

(1)步骤(Ⅰ)中分离操作名称 是____________。
(2)沉淀B中主要含有_________,气体D是______________;
(3)写出步骤(Ⅲ)中生成FeCl3的化学方程式____________________;
(4)步骤(Ⅲ)中,将氯气换成H2O2也能达到同样的目的,写出H2O2将Fe2+氧化为Fe3+的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图带漏斗U型管中装有足量的煤油和水的混合物,静置后投入一小块碱金属.可观察到金属在煤油和水的界面a附近上下往复运动,下列说法不正确的是( )
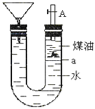
A. 此碱金属可能是钾或钠
B. 反应一段时间煤油会燃烧
C. 碱金属上下运动是由于与水反应产生了氢气
D. 若是金属锂则不能观察到上述现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物。下列关于螺[4,4]王烷(![]() )的说法错误的是
)的说法错误的是
A. 与环壬烯互为同分异构体 B. 二氯代物有12种(不含立体异构)
C. 所有碳原子不可能都处于同一平面 D. 螺环烷的分子式通式为CnH2n-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A原子核内只有1个质子;B原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C原子最外层的电子数比次外层的多4;C的简单阴离子与D的阳离子具有相同的电子层结构,两元素可形成化合物D2C;C、E同主族。回答下列问题:
(1)B在元素周期表中的位置为______________________。
(2)E的氧化物对应的水化物有______________________ (写化学式)。
(3)B、C、D、E形成的简单离子半径由大到小的关系是______________________(用离子符号表示)。
(4)化合物D2C的形成过程为______________________(用电子式表示)。
(5)由A、B、C三种元素形成的常见的离子化合物的化学式为___________,该化合物的水溶液与强碱溶液共热发生反应的离子方程式为______________________。
(6)化合物D2EC3在一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在漂白、电镀等方面应用广泛。以木炭浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示:

已知:
室温下,①2NO+Na2O2===2NaNO2
②3NaNO2+3HCl===3NaCl+HNO3+2NO↑+H2O
③酸性条件下,NO或NO2ˉ都能与MnO4ˉ反应生成NO3ˉ和Mn2+
回答下列问题:
(1)检查完该装置的气密性,装入药品后,实验开始前通入一段时间N2,然后关闭弹簧夹,再滴加浓硝酸,加热。通入N2的作用是________________________________________。
(2)装置B中观察到的主要现象为________________________________________,发生反应离子方程式是_____________。
(3)装置D的作用是______________________________,发生反应的离子方程式是________________________________________。
(4)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和__________(写化学式)。为避免产生这些副产物,应在装置B、C间增加干燥管,则干燥管中盛放的试剂为__________(写名称)。
(5)利用改进后的装置将3.12gNa2O2完全转化为NaNO2,理论上至少需要木炭__________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C6H12O6(s)、C8H18(1)燃烧热分别是2800kJ·mol-1、5518 kJ·mol-1,下列热化学方程式正确的是( )
A. C6H12O6(s)+6O2(g)![]() 6CO2(g)+6H2O(g) △H=-2800kJ·mol-1
6CO2(g)+6H2O(g) △H=-2800kJ·mol-1
B. 0.5C6H12O6(s)+3O2(g)![]() 3CO2(g)+3H2O(l) △H=-1400kJ·mol-1
3CO2(g)+3H2O(l) △H=-1400kJ·mol-1
C. C8H18+12.5O2![]() 8CO2+9H2O △H=-5518kJ·mol-1
8CO2+9H2O △H=-5518kJ·mol-1
D. C8H18(1)+12.5O2(g)![]() 8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
8CO2(g)+9H2O(1) △H=+5518kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法正确的是

A. 制取氨气时烧瓶中的固体常用CaO或CaCl2
B. 将湿润的蓝色石蕊试纸置于三颈瓶口,试纸变红,说明NH3已经集满
C. 关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内压强变化曲线如图2,则E点时喷泉最剧烈
D. 工业上,若出现液氨泄漏,喷稀盐酸比喷洒NaHCO3溶液处理效果好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180g)是一种浅黄色晶体, 难溶于水,受热分解(文献显示其反应方程式为FeC2O4·2H2O ==FeO+CO↑+CO2↑+2H2O)。某化学兴趣小组设计如图装置,探究草酸亚铁晶体的分解反应。
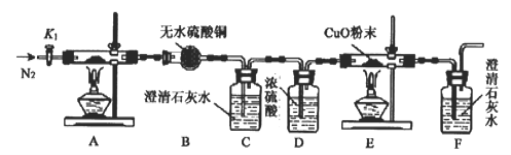
(1)该装置存在的明显缺陷为________________。
(2)设计实验步骤如下:①检查装置的气密性;②打开活塞K1,通入一段时间的N2,再关闭活塞K1;③先点燃_____处的酒精灯,再点燃________处的酒精灯。
(3)实验过程中,证明分解生成CO2的现象是_________________;而E处黑色粉末变红,证明草酸亚铁分解产中CO,若只通过F中的现象证明产生CO,则需要在C和D之间增加盛有_______溶液的洗气瓶。
(4)实验结束后,有同学打开K1,又通入一段时间的N2,使装置A中分解产生的气体全部通入后面的装置中,并将装置C、F中的沉淀过滤、洗涤、干燥、称量,测得C中沉淀质量大约是F中的3倍,重新实验得出的实验结果不变。小组成员经过讨论排除澄清石灰水不足造成的影响,提出三个假设:
a.CO在装置E中没有完全氧化;
b.使用的草酸亚铁试剂变质,有部分CO被分解过程中产生的Fe2O3氧化为CO2;
c.草酸亚铁分解时,有部分CO被FeO氧化为CO2;
小组成员于是设计如下方案验证:
①验证假设a:在E之后再增加一个相同装罝E,并增加E中CuO的量,重新实验,所得数据只有微小变化,但不足以影响实验结果,说明假设a不成立。
②验证假设b:取少量草酸亚铁晶体溶于盐酸,再加入适量的____溶液,无明显现象,证明草酸亚铁晶体没有变质,说明假设b不成立
③验证假设c:取实验后A中固体溶于盐酸,产生__________,证明假设c成立。
④实验时同时测出下列有关数据:FeC2O4·2H2O的质量为10.80g,A中剩余固体的质量为3.84g,测得实验结束后装置A中n(FeO)=________。
(5)根据实验分析,写出装置A中发生的总反应方程式_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com