
(1)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的NaCl溶液、CuSO4溶液和K2SO4溶液,电极均为石墨电极.接通电源后,甲中现象是b电极上产生刺激性气味气体.据此回答问题:

①电源的N端为________极;
②电极c上的现象为________;
③乙中总反应的化学方程式为________;
④往甲中加入________,可使溶液恢复原状.
如果乙装置电解过程中铜全部析出,此时电解能不能继续进行(填“能”、“不能”)________.
(2)臭氧是常见的强氧化剂.制取臭氧的方法之一是电解纯水(原理如下图).
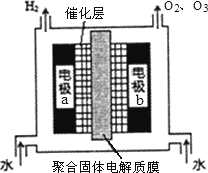
①电极a为________极(填“阴”或“阳”)
②写出电极b生成臭氧的电极反应式________;电极b附近的溶液呈________性(填“酸”或“碱”).
科目:高中化学 来源: 题型:阅读理解
| ||
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年天津一中高二下学期期中考试化学试题 题型:填空题
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题:

(1)电源的N端为 极;
(2)写出电解前后各溶液的pH变化情况(增大、减小或不变):
甲溶液 ;乙溶液 ;丙溶液 ;
(3)电极b上生成的气体在标准状态下的体积是 ;
电极c的质量变化是 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com