
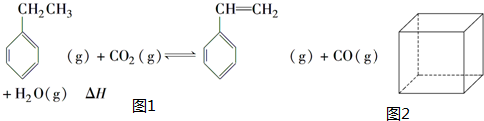
 .立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).
.立方烷(C8H8)的键线式结构如图2所示,它和苯乙烯的关系是同分异构体(填“同位素”、“同素异形体”、“同分异构体”或“同系物”).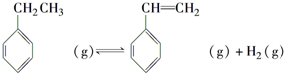 △H1=+117.6kJ•mol-1
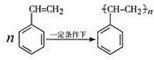
△H1=+117.6kJ•mol-1分析 (1)苯乙烯中的碳碳双键可以发生加聚反应得到聚苯乙烯,注意单体前面的系数n;苯乙烯的分子式为:C8H8,两者分子式相同,但结构不同,所以是同分异构体;
(2)根据盖斯定律结合热化学方程式分析;化学反应自发进行的判断依据是△H-T△S<0,由焓变和熵变和温度共同决定;
(3)负极发生氧化反应,一氧化碳放电;1mol氧气参加反应转移4mol的电子由此分析解答;
(4)①根据浓度熵规则计算Qc是否等于K来计算;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
解答 解:(1)苯乙烯在一定条件下合成聚苯乙烯的化学方程式为: ,苯乙烯的分子式为:C8H8,两者分子式相同,但结构不同,所以是同分异构体,
,苯乙烯的分子式为:C8H8,两者分子式相同,但结构不同,所以是同分异构体,
故答案为: ,同分异构体;
,同分异构体;
(2)方程①+方程②得到: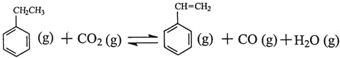 ,所以该反应的反应热为:△H=△H1+△H2=+117.6kJ/mol+(-41.2)kJ/mol=+76.4KJ/mol,△H>0,而△S>0,所以要想自发必须在高温的条件下,故答案为:+76.4KJ/mol;A;
,所以该反应的反应热为:△H=△H1+△H2=+117.6kJ/mol+(-41.2)kJ/mol=+76.4KJ/mol,△H>0,而△S>0,所以要想自发必须在高温的条件下,故答案为:+76.4KJ/mol;A;
(3)负极发生氧化反应,一氧化碳放电,电极方程式为CO-2e-+CO32-=2CO2;11.2L氧气的物质的量为0.5mol,所以转移2mol的电子,即转移电子数为2NA,故答案为:CO-2e-+CO32-=2CO2;2NA;
(4)①反应 进行到某时刻测得混合物中各组分的物质的量均为1.0mol,即浓度都是0.5mol/L,此时Qc=$\frac{0.{5}^{3}}{0.{5}^{2}}$=0.5=K,所以达到化学平衡状态,即v正=v逆,
进行到某时刻测得混合物中各组分的物质的量均为1.0mol,即浓度都是0.5mol/L,此时Qc=$\frac{0.{5}^{3}}{0.{5}^{2}}$=0.5=K,所以达到化学平衡状态,即v正=v逆,
故答案为:=;
②A.混合气体的平均相对分子质量不变,说明总物质的量不变,达平衡状态,故正确;
B.混合气体的密度一直不变,故错误
C.CO的正、逆反应速率相等,达平衡状态,故正确;
故选B.
点评 本题综合性较大,涉及化学平衡状态的判断、浓度熵规则、盖斯定律的计算等知识,注意知识的归纳和整理是关键,难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ④⑥⑦⑧ | C. | ①④⑥⑦ | D. | ②③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=1,b=4 | B. | a=3,b=3 | C. | a=2,b=3 | D. | a=3,b=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 | 无银镜生成 | 淀粉未发生水解 |
| B | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2 mL 0.1 mol/L Na2S溶液中滴几滴0.1 mol/L ZnSO4溶液;再加入几滴0.1 mol/L CuSO4溶液 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | |
| B. | 元素R最高正价为+7价,表明R元素一定是ⅦA族元素 | |
| C. | 从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 | |
| D. | 若M+和R2-具有相同的电子层结构,则原子半径:M<R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
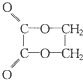 )的正确顺序是( )
)的正确顺序是( )| A. | ①⑤②③④ | B. | ①②③④⑤ | C. | ②③⑤①④ | D. | ②③⑤①⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com