
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
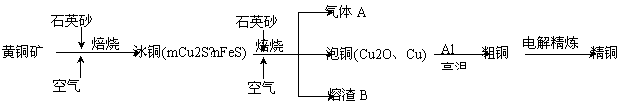

(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 (填 离子符号),检验溶液中还存 在Fe2+的方法是 (注明试剂、现象)。
在Fe2+的方法是 (注明试剂、现象)。
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某研究小组将纯净的SO2气体通入0.1mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能氧化通入的SO2,该小组突出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1) 验证假设
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
| 实验步骤 | 实验现象 | 结论 |
| 实验1:在盛有不含O2的25ml0.1mol/LBaCl2溶液的烧杯中,缓慢通入纯净的SO2气体 | 假设一成立 | |
| 实验2:在 |
(2)为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入下图

实验1中溶液pH变小的原因是____;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
验证假设二
请设计实验验证假设二,写 出实验步骤,预期现象和结论。
出实验步骤,预期现象和结论。
| 实验步骤、预期现象和结论(不要求写具体操作过程) |
若假设二成立,请预测:在相同条件下,分别通入足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反映后两溶液的pH前者_______(填大于或小于)后者,理由是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作、现象和结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层溶液 显紫红色 | 氧化性:Fe3+>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:

回答下列问题:
(1)写出反应1的化学方程式 ;
(2)滤液Ⅰ中加入CaO生成的沉淀是 ,反应2的离子方程式为 ;
(3)E可作为建筑材料,化合物C是 ,写出由D制备冰晶石的化学方程式 ;
(4)电解制铝的化学方程式是 ,以石墨为电极,阳极产生的混合气体的成分是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
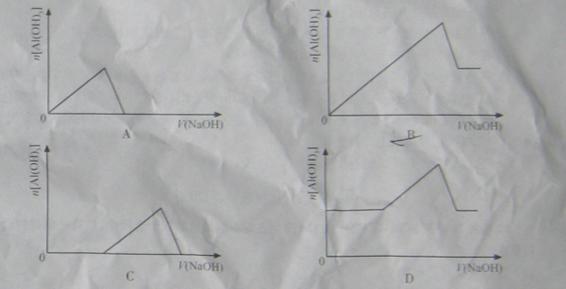
已知室 温下,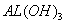 的K,或溶解度远大于
的K,或溶解度远大于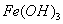 。向浓度均为0.1
。向浓度均为0.1

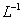 的
的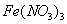 和
和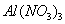 混合溶液中,逐滴加入NaOH 溶液。下列示意图表示生成
混合溶液中,逐滴加入NaOH 溶液。下列示意图表示生成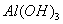 的物质的量与加入NaOH溶液的体积的关系 。合理的是
的物质的量与加入NaOH溶液的体积的关系 。合理的是
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定地方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 反应制备,FeCl3可用铁粉和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
石墨在材料领域有重要应用。某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯与综合利用工艺如下:
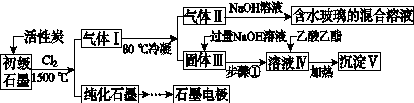
(注:SiCl4的沸点为57.6 ℃,金属氯化物的沸点均高于150 ℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是____________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体Ⅰ中的碳氧化物主要为________。由气体Ⅱ中某物得到水玻璃的化学反应方程式为____________________________________________。
(3)步骤①为:搅拌、________。所得溶液Ⅳ中的阴离子有________。
(4)由溶液Ⅳ生成沉淀Ⅴ的总反应的离子方程式为______________________________________________,100 kg初级石墨最多可能获得Ⅴ的质量为______kg。
(5)石墨可用于自然水体中铜件的电化学防腐,完成如图防腐示意图,并作相应标注。
查看答案和解析>>
科目:高中化学 来源: 题型:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用铅蓄电池进行电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极为Pb+SO42﹣═PbSO4+2e﹣,
正极为PbO2+4H++SO42﹣+2e﹣═PbSO4+2H2O,
今若制得Cl2 0.025mol,这时电池内消耗的H2SO4的物质的量至少是()
A. 0.025 mol B. 0.050 mol C. 0.10 mol D. 0.20 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com