
【题目】(1)下列物质①H2O,②CuO,③CuSO4,④NaOH,⑤氨水,其中属于氧化物的是__________,(请填序号,下同)属于盐的是__________,属于混合物的是__________,属于电解质的是__________。
(2)在氮的化合物中,红棕色、有刺激性气味的有毒气体是__________,(填写化学式)
(3)根据反应 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
MnCl2+Cl2↑+2H2O,回答下列问题:还原剂是__________,还原产物是__________,氧化剂是__________,氧化产物是__________。
(4)纯净的H2在Cl2中燃烧发出__________色火焰。
(5)金属钠切开后,光亮的金属断面__________,说明常温下钠能够跟__________反应,生成__________;钠投入水中,钠__________水面上,并四处游动,发出响声,这说明__________,熔成一个闪亮的小球,最后向烧杯中滴加酚酞,溶液__________。
(6)配平:①_____HNO3(稀)+____Cu=_____Cu(NO3)2+____H2O+ NO↑
②___H2SO4(浓)+_____C![]() _____CO2↑+_____SO2↑+_____H20
_____CO2↑+_____SO2↑+_____H20
【答案】①② ③ ⑤ ①②③④ NO2 MnO2 MnCl2 浓HCl Cl2 苍白 变暗 氧气 氧化钠 浮在 有气体生成 红色 3;8;3;2;4 1;2;1;2;2;2
【解析】
(1)氧化物是指只含有两种元素,其中是氧元素的化合物;混合物是由多种物质组成的物质;在水溶液里或熔融状态下能导电的化合物是电解质,电解质首先必须是化合物;
(2)二氧化氮是红棕色、有刺激性气味的有毒气体;
(3)二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水的反应中,锰元素化合价降低被还原,氯元素化合价升高,被氧化;
(4)钠常温下与氧气反应生成氧化钠;钠的密度比水小,与水反应生成氢氧化钠和氢气;
(5)①稀硝酸具有强氧化性,铜与稀硝酸反应生成硝酸铜、一氧化氮和水;
②浓硫酸具有强氧化性,碳与浓硫酸共热反应生成二氧化硫、二氧化碳和水。
(1)按照物质的分类原则及相关概念可知①H2O是氧化物,属于弱电解质,②CuO是氧化物,属于电解质,③CuSO4是盐,属于电解质,④NaOH是碱,属于电解质,⑤氨水是一水合氨的水溶液,属于混合物,则属于氧化物的是①②,属于盐是③,属于混合物是⑤,属于电解质是①②③④,故答案为:①②;③;⑤;①②③④;
(2)二氧化氮是红棕色、有刺激性气味的有毒气体,故答案为:NO2;
(3)二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水的反应中,锰元素化合价降低被还原,氯元素化合价升高,被氧化,则二氧化锰是氧化剂,氯化锰是还原产物,浓盐酸是还原剂,氯气是氧化产物,故答案为:MnO2;MnCl2;浓HCl;Cl2;
(4)纯净的H2在Cl2中安静地燃烧发出苍白色火焰,故答案为:苍白;
(5)金属钠切开后,光亮的金属断面变暗,说明常温下钠能够跟氧气反应,生成白色的氧化钠;钠投入水中,浮在水面上,并四处游动,发出响声,这说明有气体生成,熔成一个闪亮的小球,最后向烧杯中滴加酚酞,溶液呈红色,故答案为:变暗;氧气;氧化钠;浮在;有气体生成;红色;
(5)①稀硝酸具有强氧化性,铜与稀硝酸反应生成硝酸铜、一氧化氮和水,反应的化学方程式为3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O,故答案为:3;8;3;2;4;
②浓硫酸具有强氧化性,碳与浓硫酸共热反应生成二氧化硫、二氧化碳和水,反应的化学方程式为C+2H2SO4(浓) ![]() CO2 ↑+2SO2 ↑+2H2O,故答案为:1;2;1;2;2;2。
CO2 ↑+2SO2 ↑+2H2O,故答案为:1;2;1;2;2;2。


科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+的电子排布式为_________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为______(用元素符号表示),苯酚中碳原子的杂化轨道类型为_______。
(3)FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是________。FeSO4常作补铁剂,SO42-的立体构型是__________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1 mol Fe(CO)5分子中含________molσ键,与CO互为等电子体的离子是__________(填化学式,写一种)。
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为_____。

(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe3+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短核间距为___________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
![]()
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差3
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质长期露置于空气中会变质,且变质过程中涉及氧化还原反应的是
①Na ②NaOH ③FeSO4 ④氯水
A.①②B.②③C.①③④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 增大压强或升高温度,一定能使化学反应速率加快
B. 已知Ni(CO)4(g)=Ni(s)+4CO(g) ΔH=Q kJ/mol,则Ni(s)+4CO(g)=Ni(CO)4(g) ΔH=-Q kJ/mol
C. 500℃、30 MPa下,0.5 mol N2(g)和1.5 mol H2(g)反应生成NH3(g)放热Q kJ,其热化学方程式为N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-2Q kJ/mol
2NH3(g) ΔH=-2Q kJ/mol
D. 已知两个平衡体系:2NiO(s) ![]() 2Ni(s)+O2 (g),2CO(g)+O2(g)
2Ni(s)+O2 (g),2CO(g)+O2(g) ![]() 2CO2(g)的平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g)
2CO2(g)的平衡常数分别为K1和K2,可推知平衡NiO(s)+CO(g) ![]() Ni(s)+CO2(g)的平衡常数为
Ni(s)+CO2(g)的平衡常数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z在元素周期表中的相对位置如表所示,这四种元素的原子最外层电子数之和为21。下列说法不正确的是
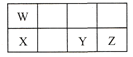
A.原子半径大小:X > Y > Z
B.W、Y两种元素都能与氧元素形成化合物WO2、YO2
C.氧化物对应水化物的酸性: Z > Y > W
D.Y能形成H2Y、H2YO4的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验中需配制1.0 mol/L的NaOH溶液950 mL,假如其他操作均是准确无误,以下情况会引起配制溶液浓度偏高的是
A.称取40.0gNaOH固体
B.容量瓶水洗后未烘干直接使用
C.定容时俯视
D.摇匀后发现液面低于刻度线,继续加水至液面与刻度线平齐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 聚乙烯塑料和天然橡胶均不能使溴水褪色
B. 2-丁烯分子中所有原子有可能在同一平面
C. 丙烯和环己烷的二氯代物的数目相同(不考虑立体异构)
D. 将溴乙烷和氢氧化钠的乙醇溶液共热产生的气体通入溴水中,溶液褪色,说明有乙烯生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B. 4.0g由H218O与D2O组成的混合物中所含中子数为2NA
C. 标准状况下,11.2LHF含有0.5NA个HF分子
D. 电解精炼铜时转移了NA个电子,阳极溶解32g铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com