
分析 (1)NH4Cl是强酸弱碱盐,水解呈酸性,其原因是 NH4++H2O?NH3•H2O+H+;
(2)假设铵根离子不考虑水解,依据另一种离子的影响分析判断;
(3)醋酸根离子水解促进铵根离子水解,NH4HSO4 溶液中的氢离子抑制铵根离子的水解;
(4)0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,而氯离子浓度等于0.1mol/L,溶液呈碱性,所以氢氧根离子的浓度大于氢离子的浓度,由此分析离子浓度的大小.
解答 解:(1)NH4Cl是强酸弱碱盐,水解呈酸性,其原因是 NH4++H2O?NH3•H2O+H+,故答案为:酸; NH4++H2O?NH3•H2O+H+;
(2)假设铵根离子不考虑水解,①0.1mol/L NH4Cl中铵根离子浓度0.1mol/L;②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性;④0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈碱性;⑤0.1mol/L NH3•H2O,一水合氨是弱碱存在电离平衡,溶液中铵根离子浓度原小于0.1mol/L,溶液呈碱性;所以溶液PH最小的是③,铵根离子浓度最小的是⑤;故答案为:③;⑤;
(3)②0.1mol/L CH3COONH4 醋酸根离子水解促进铵根离子水解,铵根离子浓度小于0.1mol/L;③0.1mol/L NH4HSO4 溶液中的氢离子抑制铵根离子的水解,铵根离子浓度大于0.1mol/L,溶液呈酸性溶液②、③中c(NH4+)的大小关系是小于,故答案为:<;
(4)0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液中,一水合氨电离程度大于铵根离子的水解,铵根离子浓度大于0.1mol/L,而氯离子浓度等于0.1mol/L,溶液呈碱性,所以氢氧根离子的浓度大于氢离子的浓度,所以离子浓度的大小为:[NH4+]>[Cl-]>[OH-]>[H+],故答案为:[NH4+]>[Cl-]>[OH-]>[H+].
点评 本题考查了盐类水解的应用,溶液中离子浓度的比较,水解平衡的变化分析,溶液中的电荷守恒应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 10种 | C. | 12种 | D. | 14种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热氢氧化铁固体 | B. | 金属钠露置于空气中 | ||
| C. | 灼热的铜丝放在氯气中燃烧 | D. | 将氯气通入冷的消石灰浊液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
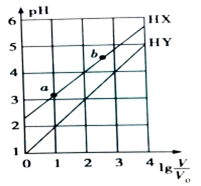 常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )
常温下,浓度均为0.1mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示(不考虑HX、HY和H2O的挥发),下列叙述正确的是( )| A. | HX和HY都是弱酸,且HX的酸性比HY的弱 | |
| B. | HX的电离程度:a点大于b点 | |
| C. | HX溶液由a点稀释至b点时,由水电离出的c(H+)•c(OH-)不变 | |
| D. | 当lg$\frac{V}{{V}_{0}}$=3时,若两溶液同时升高温度,则$\frac{c({X}^{-})}{c({Y}^{-})}$增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不再变化 | |
| B. | Fe3O4的物质的量不变 | |
| C. | v(H2O)=v(H2) | |
| D. | 断裂4molH-O键的同时,断裂4molH-H键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的盐酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 | |
| B. | 25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能减小 | |
| C. | 浓度均为0.1mol•L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>NaHCO3>(NH4)2SO4>NH4Cl | |
| D. | 为确定H2A是强酸还是弱酸,可测0.1mol•L-1NaHA溶液的pH,若pH>1,则H2A是弱酸;若pH=1,则H2A是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Al3+、Cl-、OH- | B. | H+、Na+、CO32-、NO3- | ||
| C. | Cu2+、K+、SO42-、NO3- | D. | Na+、H+、OH-、Ca2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com