
(19分) A + B → X + Y + H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当A、B的物质的量之比为1∶4且A为黑色固体时,该反应的离子方程式是 ;
②当A、B的物质的量之比为1∶6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移:__________________________________________。
③实验室处理尾气Y时常用NaOH而不用NaHSO3溶液,其原因是(用离子反应方程式表示)_____________________________________________________________。
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1∶2时,则A可能为______,检查其中刺激性气体产物X的方法是____________________。
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1∶4反应。
①过量的A和100mL2mol/L的B溶液充分反应后将溶液稀释至500mL后溶液中阴离子的物质的量浓度为_____________。
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量之比为1∶2时,则被还原的X是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(5)若A、B、X、Y均为化合物。X为极易溶于水的气体,则盐A是_______盐,X极易溶于水的原因是:________________________________________________。
(1) ① MnO2 + 4H+ + 2Cl— 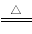 Mn2+ + Cl2↑+ 2H2O (2分)
Mn2+ + Cl2↑+ 2H2O (2分)
② 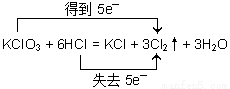 (3分)
(3分)
③ 4HSO3— + Cl2=SO42— + 2Cl— + 3SO2↑ + 2H2O(2分)(或分步写)
(2) ①C、Cu (2分);②将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2 (或其它合理答案) (2分) (3) ①0.3mol/L (2分); ②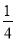 a或
a或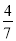 a (2分)
a (2分)
(4) NaAlO2 NaCl(2分) (5)铵,X(或NH3)和H2O间易形成分子间氢键 (2分)
【解析】
试题分析:(1)如果Y是黄绿色气体,则Y一定是氯气,则
①当 A、B的物质的量之比为1∶4且A为黑色固体,这说明该反应为二氧化锰与浓盐酸混合加热制备氯气,反应离子方程式为MnO2 + 4H+ + 2Cl—  Mn2+ + Cl2↑+ 2H2O;
Mn2+ + Cl2↑+ 2H2O;
②当 A、B的物质的量之比为1∶6,则应该是氯酸钾与盐酸反应制备氯气,同时还有生成氯化钾与水生成,反应的化学方程式为KClO3+6HCl=KCl+3H2O+3Cl2↑。反应中氧化剂是氯酸钾,还原剂是氯化氢,根据电子得失守恒可知氧化剂与还原剂的物质的量之比是1:5,即反应中转移5个电子,所以用双线桥表示反应过程中的电子转移为 ;
;
③氯气具有强氧化性,而亚硫酸氢钠检验还原性,二者能发生氧化还原反应生成酸、钠盐与水。反应中产生的酸能与亚硫酸氢钠反应产生二氧化硫,SO2是大气污染物,因此一般不用亚硫酸氢钠,而用氢氧化钠,反应的离子方程式为4HSO3— + Cl2=SO42— + 2Cl— + 3SO2↑ + 2H2O;
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,该反应应该是碳与浓硫酸反应生成CO2、二氧化硫与水,或铜与浓硫酸反应生成硫酸铜、二氧化硫与水,刺激性气体产物X为二氧化硫,SO2具有漂白性,能使品红溶液褪色,因此检验二氧化硫的方法为:将气体X通入品红溶液中,若品红溶液褪色,证明气体X是SO2;
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中,因此A是铁,而不是铝,即该反应为Fe与稀硝酸反应生成硝酸铁、NO与水。
①100mL2mol/L的硝酸溶液中硝酸的物质的量=0.1L×2mol/L=0.2mol,根据反应3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,生成硝酸亚铁的物质的量=0.2mol×3/8=0.075mol,其中硝酸根离子的物质的量是0.075mol×=0.15mol,所以稀释至500mL后溶液中阴离子的物质的量浓度为0.15mol÷0.5L=0.3mol/L;
②铁离子能氧化单质铁生成亚铁离子,设被还原的硝酸铁的物质的量是xmol,则根据反应的方程式可知
2Fe3++Fe=3Fe2+
2 3
x mol 1.5x mol
则(a-x):1.5x=1:2
解得x=4a/7
或(a-x):1.5x=2:1
解得x=a/4
(4)若A、B、X、Y均为化合物.向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀,白色沉淀是氯化银,则A中含有Cl-;B的焰色反应为黄色,应该含有Na元素。如果A和B按物质的量之比1:3反应产生白色沉淀,则A为氯化铝、B为氢氧化钠;如果A与B按物质的量之比1:4反应则恰好生成偏铝酸钠、氯化钠和水,反应的化学方程式为AlCl3+4NaOH=NaAlO2+3NaCl+H2O,因此反应后溶液中溶质的化学式为NaAlO2、NaCl;
(5)若A、B、X、Y均为化合物.X为极易溶于水的气体,X应该是氨气,则A是铵盐,B为强碱。 NH3和H2O间易形成分子间氢键,所以氨气极易溶于水。
考点:考查无机框图题推断


科目:高中化学 来源:2014-2015学年山东省济宁市高三上学期期中化学试卷(解析版) 题型:选择题
宋代著名法医学家宋慈 的《洗冤集录》中有―银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2===2X+2H2O,下列说法不正确的是
A.X的化学式为Ag2S B.银针验毒时,空气中氧气得到电子
C.反应中Ag和H2S均是还原剂 D.每生成1mo1X,反应转移2mo1 e-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省保定市高三12月联考化学试卷(解析版) 题型:选择题
将6molA和2molB在2L的密闭容器中混合并在一定条件下发生如下反应:3A(g)+B(S) 2C(g),ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
2C(g),ΔH<0,4s(秒)后反应达到平衡状态,此时测得C的浓度为1mol·L-1,下列说法中正确的是
A.4s内用物质B表示的反应速率为0.125mol·L-1·S-1
B.达到平衡后若向容器中通入惰性气体,则A的转化率增大
C.此时,A、B、C的物质的量之比为3:1:2
D.达平衡后若升高温度,C的浓度将增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三上学期期中理综化学试卷(解析版) 题型:填空题
(15分)MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下:
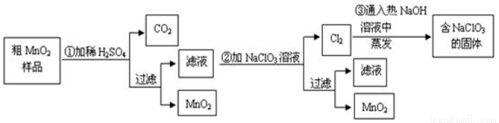
(1)在第①步反应中,为加快反应速率,可采取的措施有 (任写一种),产生CO2气体的的方程式是 ;
(2)写出步骤②中所发生的离子方程式 ;
(3)如果蒸发得到的固体中,只含NaClO3和NaCl,为得到比较纯的NaClO3溶液,结合下面各物质的溶解度与温度的关系,
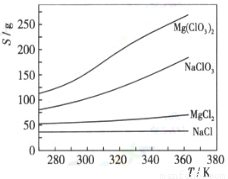
其基本操作是:将固体溶于适量水,通过 , ,便可得到较纯的NaClO3溶液。
(4)工业上也常用石墨做电极,电解酸化的MnSO4溶液来制MnO2,则阳极上所发生的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省广州市高三上学期期中理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1mol苯分子含有3NA个C-C键
B.一定条件下,1mol N2和3mol H2充分混合,反应后转移的电子数为6NA
C.常温下,78.0g Na2O2与58.5g NaCl所含阴离子数相等
D.标准状况下,2.24L CCl4所含分子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:选择题
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
A.0.3 mol NO2、0.1 mol NO B.0.3 mol NO、0.1 mol NO2
C.0.6 mol NO D.0.3 mol NO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三11月月考化学试卷(解析版) 题型:选择题
设nA是阿伏加德罗常数的数值。下列说法正确的是
A.1L 0.1mol·L-1的FeCl3溶液中,Fe3+的数目为0.1nA
B.1molNH3中含有N-H键的数目为3nA
C.7.8g Na2O2中含有的阳离子数目为0.1nA
D.标准状况下,22.4L水中分子个数为nA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
下列事实能用勒夏特列原理来解释的是
A.实验室采用排饱和食盐水的方法收集Cl2
B.500℃左右的温度比室温更有利于合成氨反应
C.H2、I2、HI平衡混合气体加压后颜色加深
D.SO2氧化为SO3,往往需要使用催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
下列原子结构模型与科学家对应不正确的一项是:
A.阿伏加德罗的原子学说
B.汤姆生的“葡萄干面包式”原子结构模型
C.卢瑟福的带核原子结构模型
D.玻尔的核外电子在一定轨道上运动的观点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com