
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
分析 A.乙烯密度与空气相近,不能用排空法收集;
B.氯气与碳酸氢钠溶液反应;
C.Na2O2或H2O2作反应物,均为固体与液体反应,且不需要加热;
D.二氧化氮和水反应生成硝酸同时生成一氧化氮也是污染气体.
解答 解:A.乙烯密度与空气相近,不能用排空法收集,因用排水法收集,故A错误;
B.氯气溶于水和水反应生成盐酸和次氯酸是化学平衡,盐酸和碳酸氢钠能发生反应促进平衡正向进行,生成的氯气通过饱和NaHCO3溶液不能制得氯气,故B错误;
C.用Na2O2或H2O2作反应物制备氧气都是利用固体和液体不和加热反应生成,应选择分液漏斗中的液体加入过氧化钠中反应或过氧化氢从分液漏斗中滴入固体二氧化锰催化作用发生反应生成氧气,应选择相同的气体发生装置,故C正确;
D.二氧化氮和水反应生成硝酸同时生成一氧化氮也是污染气体,不能被吸收,氢氧化钠溶液可以吸收二氧化氮气体,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、气体的收集和制备、尾气处理等为解答的关键,侧重实验技能的考查,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
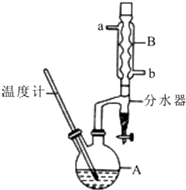 正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:
正丁醚常用作有机反应的溶剂.实验室制备正丁醚的反应和主要实验装置如下:2CH3CH2CH2CH2OH$?_{135℃}^{浓硫酸}$(CH3CH2CH2CH2)2O+H2O,反应物和产物的相关数据如表:| 相对分子质量 | 沸点/℃ | 密度/(g/cm3) | 水中的溶解性 | |
| 正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
| 正丁醚 | 130 | 142.0 | 0.7704 | 几乎不容 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
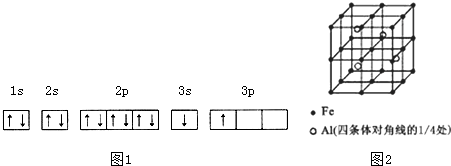
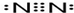 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
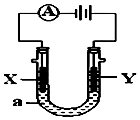 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com