
| A. | 分液时,下层液体从分液漏斗下口放出,上层液体从上口倒出 | |
| B. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| C. | 蒸馏操作时,使用的冷凝水应该由低往高流,形成逆流 | |
| D. | 蒸发操作时,应使混合物中的水分子蒸干后,才能停止加热 |
分析 A.分液时避免上下层液体混合;
B.发黑可知蔗糖中H、O元素以水的形式脱出;
C.冷水下进上出,停留时间长;
D.蒸发时,不能蒸干,利用余热加热.
解答 解:A.分液时避免上下层液体混合,则下层液体从分液漏斗下口放出,上层液体从上口倒出,故A正确;
B.发黑可知蔗糖中H、O元素以水的形式脱出,则说明浓硫酸具有脱水性,故B正确;
C.冷水下进上出,停留时间长,形成逆流,冷却效果好,故C正确;
D.蒸发时,不能蒸干,利用余热加热,当出现大量晶体时停止加热,故D错误;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯实验操作为解答的关键,侧重分析与实验能力的考查,注意实验技能及评价分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中c(H+)/c(CH3COOH)值增大 | |
| B. | 25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O?H++OH-逆向移动,c(H+)降低 | |
| C. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入 0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| D. | 常温下,将pH=11的Ba(OH)2溶液加水稀释10倍后,溶液的pH=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
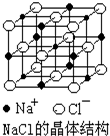 NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )
NaCl晶体结构如图所示,现测知NaCl晶体中Na+与Cl-平均距离为a cm,该晶体密度为ρg•cm-3,则阿伏加德罗常数可表示为( )| A. | $\frac{0.585}{4{a}^{3}ρ}$ | B. | $\frac{5.85}{8{a}^{3}ρ}$ | C. | $\frac{58.5}{2{a}^{3}ρ}$ | D. | $\frac{58.5}{{a}^{3}ρ}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.
=$\frac{ax}{2}$mol,n(Cl2)=(1-x)a.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X是SO2,它既有氧化性又有还原性 | |
| B. | 干燥的气体Y不能使干燥的有色布条褪色,其水溶液具有漂泊作用的是HClO | |
| C. | Z与水反应的化学方程式为:3NO2+H2O=2HNO3+NO | |
| D. | 等物质的量的X与Y同时通入到湿润的有色布条上,有色布条褪色时间变短,漂泊效果增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色液中加BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有Ag+ | |
| B. | 向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- | |
| C. | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华 | |
| D. | 向NaBr溶液中滴入少量氯水和CCl4,振荡、静置,溶液下层呈橙红色,说明Br-还原性强于Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com