
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表。下列说法错误的是
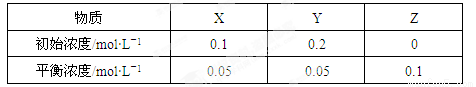
A.反应达到平衡时,X的转化率为50%
B.改变温度可以改变此反应的平衡常数
C.反应可表示为X+3Y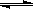 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示,则下列说法中错误的是
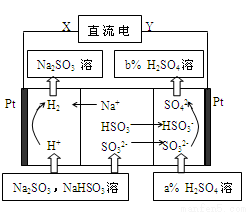
A.X为直流电源的负极,Y为直流电源的正极
B.图中两处硫酸的质量分数b>a
C.该过程中的产品主要为H2SO4和H2
D.阳极区pH增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高一上学期期中化学试卷(解析版) 题型:选择题
某KCl、MgCl2、Mg(NO3)2形成的混合中,c(K+)=0.20mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.20mol/L,则c(NO3-)为
A.0.15mol/L B.0.10mol/L C.0.25mol/L D.0.50mol/L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:填空题
(12分)已知某反应在不同条件下的反应历程可以表示成下图,
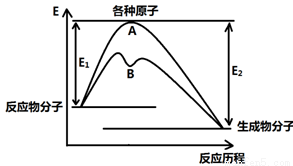
E1表示反应物分子变成原子所吸收的热量,E2表示这些原子重新成键形成生成物放出的热量,请回答下列问题:
(1)据图判断该反应是 (填“吸”或“放”)热反应,如该反应可逆,则其达到平衡后,其他条件不变,升高温度,反应物的转化率 (填“增大”、“减小”或“不变”),其中B历程表明此反应改变的条件为 (填字母)。
A.增大反应物的浓度 B.降低温度 C.增大压强 D.使用催化剂
(2)下表给出了一些化学键的键能:
化学键 | H—H | Cl—Cl | O=O | O—H | H—Cl |
键能(kJ·mol-1) | 436 | 247 | x | 463 | 431 |
①若图中表示反应H2(g) +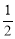 O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
O2(g)=H2O(g) ΔH= - 241.8 kJ·mol-1,则x= kJ·mol-1(保留一位小数)。
②催化剂、加热条件下可用氧气与氯化氢气体反应置换出氯气,同时生成另一种气态化合物,利用上表数据写出该热化学方程式 ,当该反应中有1 mol电子发生转移时,图像中历程A的E1= kJ(保留一位小数)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
某同学为了使反应2HCl + 2Ag 2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是:
2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是:
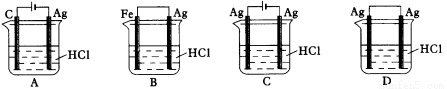
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中化学试卷(解析版) 题型:选择题
在一定温度下,反应A2(g)+B2(g)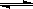 2AB(g)达到平衡的标志是(NA代表阿伏加德罗常数)
2AB(g)达到平衡的标志是(NA代表阿伏加德罗常数)
A.单位时间生成NA的A2同时生成NA的AB
B.容器内的总压不随时间变化
C.单位时间生成2NA的AB同时生成NA的B2
D.单位时间生成NA的A2同时生成NA的B2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:填空题
欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)选用的主要仪器有:
①__________,②__________,③__________,④____________,⑤____________。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线
D.洗净所用仪器
E.稀释浓H2SO4
F.将溶液转入容量瓶
其操作正确的顺序依次为__________ __________________。
(3)简要回答下列问题:
①所需浓硫酸的体积为____________mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________mL的量筒最好.
(4)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_________________________。
(5)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”下同)。②未经冷却趁热将溶液注入容量瓶中,________。③摇匀后发现液面低于刻度线再加水,________。④容量瓶中原有少量蒸馏水,________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高一11月联考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B.在常温常压下,11.2L Cl2含有的分子数为0.5NA
C.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市宝坻区四校高二11月联考化学试卷(解析版) 题型:选择题
下列说法正确的是
①活化分子间的碰撞一定能发生化学反应
②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A.①②⑤ B.③④⑥ C.③④⑤⑥ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com