
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:
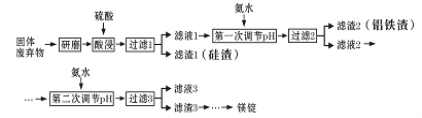
(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
【答案】⑴加快浸出速率 提高反应温度或适当增加硫酸浓度(或其他合理答案)
⑵MgSiO3+2H+=Mg2++H2SiO3
⑶使Fe3+、Al3+沉淀从而分离出来 4.0×10-5
⑷溶于适量氢氧化钠溶液,过滤得Fe(OH)3;向滤液中通入过量CO2,过滤得Al(OH)3
⑸(NH4)2SO4 ![]()
⑹Mg(OH)2+2HCl=MgCl2+2H2O、MgCl2(熔融)![]() Mg+Cl2↑
Mg+Cl2↑
【解析】浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率;因MgCO3、MgSiO3、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,其中H2SiO3形成滤渣1,滤液1中MgSO4、Al2(SO4)2 和Fe2(SO4)3,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣2的主要成分是Fe(OH)3 、Al(OH)3 ,滤液2中阴离子主要是SO42-,加入NH3·H2O后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是(NH4)2SO4。
(1)酸浸前,将固体废弃物研磨的目的是加快浸出速率,浸出步骤硫酸同固体废料中主要成份反应,从化学反应速率和化学平衡的影响因素来看,可通过升高温度提高硫酸镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,故答案为:加快浸出速率,适当提高反应温度、增加浸出时间(或其他合理答案)
(2)因MgCO3、MgSiO3、Al2O3、Fe2O3能与硫酸反应,生成了MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,其中H2SiO3形成滤渣;酸浸时,生成滤渣I的离子方程式为MgSiO3+2H+=Mg2++H2SiO3;(3)滤液I中含有MgSO4、Al2(SO4)2 和Fe2(SO4)3 ,根据阳离子以氢氧化物形式完全沉淀时溶液的pH,在调节pH至5.5时,Fe3+和Al3+已经完全沉淀,滤渣2的主要成分是Fe(OH)3、Al(OH)3 ,第一次调节pH的目的是使Fe3+、Al3+沉淀从而分离出来;当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)=Ksp[Fe(OH)3 ]/Ksp[Al(OH)3 ]==4×10-38/1×10-33=4.0×10-5;(4)设计简单方案分离滤渣2,滤渣2的主要成分是Fe(OH)3、Al(OH)3 ,利用Al(OH)3 具有两性,分离操作:溶于适量氢氧化钠溶液,过滤得Fe(OH)3;向滤液中通入过量CO2,过滤得Al(OH)3 ;(7)上述过滤后滤液中阴离子主要是SO42-,加入NH3·H2O后在调节pH至12.5时Mg2+完全沉淀,溶质主要成分是(NH4)2SO4,故答案为:(NH4)2 SO4;其阳离子的电子式为![]() ,(6)滤渣3为Mg(OH)2 ,工业上从滤渣3生产镁锭的反应:Mg(OH)2 +2HCl=MgCl2+2H2O、MgCl2(熔融)
,(6)滤渣3为Mg(OH)2 ,工业上从滤渣3生产镁锭的反应:Mg(OH)2 +2HCl=MgCl2+2H2O、MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。


科目:高中化学 来源: 题型:
【题目】(1) ![]() 用系统命名法命名:________________;
用系统命名法命名:________________;
(2)下列实验操作或对实验事实的描述中正确的说法有____________________;
① 分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
② 除去甲烷中混有的少量乙烯,可以让混合物通过盛有酸性KMnO4溶液的洗气装置
③ 苯与溴水制溴苯
④ 只用溴水就可将苯、四氯化碳、乙醇、己烯四种液体区别开来
⑤ 用分液法分离苯和硝基苯的混合物
⑥酯类在碱性条件下的水解反应叫皂化反应
⑦裂化的目的主要是制得更多的乙烯、丙烯等不饱和烃
⑧除去乙酸乙酯中的乙酸也可以用氢氧化钠溶液洗涤,然后再分液
⑨煤中含有苯、甲苯,可先干馏后分馏的方法把它们分离出来
⑩乙烷、苯、乙醇、乙酸、乙酸乙酯均可发生取代反应
(3)某芳香烃结构为![]() ,它的分子式为_____,它的一氯代物有____种。
,它的分子式为_____,它的一氯代物有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB , 则此反应可表示为( )
A.2A+3B=2C
B.A+3B=2C
C.3A+B=2C
D.A+B=C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜(Cu2(OH)2CO3)是名贵的矿物宝石孔雀石的主要成分,应用广泛,如在无机工业中用于制造各种铜化合物,有机工业中用作有机合成催化剂等等,某化学小组为了探究碱式碳酸铜生成条件对其产率的影响,设计了如下实验:
设计原理:取一定体积的碳酸钠溶液(0.5mol/L)于100mL烧杯中,进行加热,恒温后将硫酸铜溶液(5.00mL. 0.5mol/L)在不断搅拌下以一定速度逐滴加入到上述碳酸钠溶液中,反应达平衡后,静止,减压过滤,洗涤,烘干,即得到最终产品,同时有气体放出。
(1)反应原理为:________________。
(2)探究反应原料用量比对反应产物的影响。
该化学小组根据所提供试剂设汁两个实验来说明反应原料用量对产品的影响
提供试剂:0.5mol/LNa2CO3溶液、0.5mol/LCuSO4溶液。
①请填写下表的空白处:
① | ② | ③ | ④ | |
硫酸铜溶液体积/mL | 2.0 | 2.0 | 2.0 | 2.0 |
碳酸钠溶液体积/mL | 1.6 | 2.0 | 2.8 | |
Na2CO3/CuSO4mol/比) | 0.8 | 1 | 1.4 |
②通过实验画图可知:当比值为______,碱式碳酸铜产量最好。

(3)反应温度对产率的影响
在三支试管中各加入2.0mL0.5 mol/LCuSO4溶液另取四支试管各加入由上述实验得到的合适用量的0.5 mol /L Na2CO3溶液。从这两列试管中各取一支将它们分別置于室温、30℃、50℃、100℃的环境中数分钟后将CuSO4溶液倒入Na2CO3溶液中振荡并观察现象,发现:沉淀颜色分别为蓝色沉淀,绿色沉淀、深绿色沉淀,绿色中带有黑色沉淀,实验结果也如上图所示,请思考,为什么温度过髙产率反而下降_______,该实验加热方式为____________。
(4)分析所制得的碱式碳酸铜的质量分数。
将已准确称量的0.5g试样样品放入300mL的锥形瓶中,加入5mL醋酸,适热使其溶解,再用l00mL水将其稀释。加入2.5gKI振荡混合,经过5分钟后,加入数滴淀粉溶液,用0.1mol/L的硫代硫酸钠溶液进行滴定。当_______时即达滴定的终点。
反应的原理:2Cu2++4I- =2CuI+I2, I2+2S2O32-=2I-+S4O62-
用0.lmol/L硫代硫酸钠40 mL,那么试样中铜的质量百分率为________。
该溶液的滴定度为_______。(毎毫升标准溶液相当于被测物质的质量,单位是g/mL或mg/mL)(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关SO2说法中不正确的是:
A. SO2是污染大气的有害气体之一 B. SO2在大气中与水反应生成硫酸,产生酸雨
C. SO2可使澄清石灰水变浑浊 D. SO2能使品红溶液褪色,加热溶液颜色恢复
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机化合物结构和性质的说法正确的是
A. 乙烯、苯和乙酸均能与氢气发生加成反应
B. 某芳香烃的分子式为C10H14,常温下它可使酸性KMnO4溶液褪色,且分子结构中只有一个侧链,符合条件的烃有4种
C. 1 mol的有机物(结构如右图)最多能与含5mol NaOH的水溶液完全反应

D. 蛋白质盐析会使蛋白质失去生理活性,加热、紫外线照射等措施可使蛋白质变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合为( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 水蒸气 | 氯化铜 | 碳酸钠 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com