
(14分)
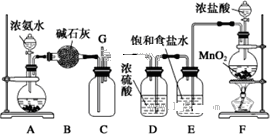
某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
A B C D E F
请回答下列问题:
(1)装置F中发生反应的离子方程式为 。
(2)装置A的烧瓶中可装试剂 。
(3)B装置的名称是 ;E装置的作用 。
(4)通入C装置的两根导管左边较长、右边较短,目的是 。
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式: 。
 当有a mol氯气参加反应时,转移的电子总数为b个,则伏加德罗数常数为(用含a、b的代数式表示)
当有a mol氯气参加反应时,转移的电子总数为b个,则伏加德罗数常数为(用含a、b的代数式表示)
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?
。
(I)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
(2)生石灰或固体氢氧化钠或碱石灰(2分)
(3)干燥管 除去氯气中的氯化氢(每空1分)
(4)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(5)3C12+8NH3=N2+6NH4Cl(2分) b/2a mol-1(2分)
(6)在G连接导管直接通人盛有烧碱的烧杯中(2分)
解析:(1)根据装置F的特点可知,F是制备氯气的,反应式为
MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
(2)A是制取氨气的,由于氨水中存在平衡NH3+H2ONH3·H2O
NH4++OH-,所以要想产生氨气,就必须使平衡向逆反应方向移动,因此A中试剂可以是生石灰或固体氢氧化钠或碱石灰等。
(3)根据装置的结构特点可判断,B是干燥管。由于浓盐酸具有挥发性,所以生成的氯气中会混有氯化氢,因此需要通过饱和食盐水除去氯化氢。
(4)由于氨气的密度小于空气的,氯气的密度大于空气的,所以要时2二者混合均匀,就必须使导管左边较长、右边较短。
(5)白烟应是氯化铵,空气中的主要成分是氮气和氧气,根据反应物的组成元素可知气体是氮气,所以反应式为3C12+8NH3=N2+6NH4Cl。1mol氯气在反应中得到2mol电子,所以amol氯气得到电子是2amol,个数是2amol×NA=b,即阿伏加德罗数常数为b/2a mol-1。
(6)氯气有毒,但可溶于强碱中,所以可将尾气直接通人盛有烧碱的烧杯中。


科目:高中化学 来源: 题型:

| ||
| ||
| b |
| 2a |
| b |
| 2a |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com